��Ŀ����
����Ŀ��ij�����о�С���������ͼ��ʾװ��(�缫���Ͼ�Ϊ��)����װ�ÿɽ���ҵ��ˮ�е��Ұ�(CH3CH2NH2)ת�����������ʡ����з����������

A. �缫NΪ��صĸ���
B. ��ع���ʱ��H+���Ҽ���ͨ������Ĥ�ƶ�������
C. N�缫�ĵ缫��Ӧ����ʽΪ2CH3CH2NH2+8H2O��30e��=4CO2��+N2��+30H+
D. ������(���躬����20%)�Ľ�����Ϊ7.5molʱ�����Դ������Ұ�9%(��������)�ķ�ˮ0.1kg
���𰸡�D
��������
�������֪����װ���ǽ���ѧ��ת��Ϊ���ܵ�ԭ��أ�ͨ�������M���ǵ�������������Ҷ�����ˮ��N���Ǹ������������ҺΪ������Һ���������Ҷ���ʧ���ӷ���������Ӧ�������������õ��ӷ�����ԭ��Ӧ����Һ��H+�������ƶ���
A������Ҷ�����ˮ��N���Ǹ������������Ҷ���ʧ���ӷ���������Ӧ����A��ȷ��
B���ع���ʱ��H+�������ƶ������Ҽ���ͨ������Ĥ�ƶ�����������B��ȷ��
C������Ҷ�����ˮ��N���Ǹ������������Ҷ���ʧ���ӷ���������Ӧ�����������Ķ�����̼�͵������缫��ӦʽΪ2CH3CH2NH2+8H2O��30e��=4CO2��+N2��+30H+����C��ȷ��
D�7.5mol������20%���������������ʵ���Ϊ1.5mol���ɵ�ʧ������Ŀ�غ��֪4n(O2)=15n(CH3CH2NH2)��n(CH3CH2NH2)=0.4mol��m( CH3CH2NH2)=0.4mol��45g/mol=18g�����Ұ�9%(��������)�ķ�ˮ������Ϊ18g��9%=0.2kg����D����
��ѡD��

 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�����Ŀ���ڲ�ͬ�¶��£���V L�ܱ������м���0.5 mol NO��0.5 mol����̿��������Ӧ��
2NO(g)+C(s)![]() N2(g)+CO2(g) ��H= ��Q kJ��mol-1(Q>0)���ﵽƽ��ʱ���������£�
N2(g)+CO2(g) ��H= ��Q kJ��mol-1(Q>0)���ﵽƽ��ʱ���������£�
�¶ȣ��� | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
�����й�˵����ȷ����
A. ��������Ϣ����֪��T1 > T2
B. T2��ʱ������Ӧ��ƽ�������С�����������c (N2)��c (NO)����
C. T1��ʱ������ʼʱ��Ӧ�����������Сһ�룬ƽ���NO��ת��������
D. T1��ʱ���÷�Ӧ��ƽ�ⳣ��![]()
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����
�� �ȣ��棩 | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�������ϱ����ݿ�֪�÷�ӦΪ_____ ������ȣ����ȣ���ȷ��������Ӧ��
�����д�ʩ������������ԭ��������_____������ţ���
a������ѹǿ�����ںϳɰ� b��ʹ�ú��ʵĴ��������ڿ������ɰ�
c����������Ҫ�����¶���500��C���� d����Ҫʹ�ù�����N2�����H2ת����
��2��0.2mol��������ˮ�����뺬��0.2mol�������Һ��Ӧ����QkJ���������Ȼ�ѧ����ʽ��ʾ�䷴Ӧʽ_____��
��3������ʱ����amol��������ˮ����ͨ��bmol�Ȼ��⣬��Һ���Ϊ1L����c��NH4+��=c��Cl��������һˮ�ϰ��ĵ���ƽ�ⳣ��Kb=_____����ab��ʾ����
��4��ԭ����H2��ͨ����Ӧ CH4��g��+H2O ��g��![]() CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�![]() �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
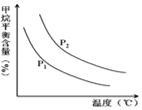
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1_____P2�����������=����������
����������һ���������¶ȣ������IJ��ʻ�__�����������С����С�������䡱���䣩��
��5��ԭ����H2����ͨ����ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����ȡ��
CO2��g��+H2��g����ȡ��
��T��ʱ�����ݻ��̶�Ϊ5L�������г���1molˮ������1mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0.08molL��1�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ_____��
�ڱ����¶���ΪT�����ݻ����Ϊ5L���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬����_____������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6



