题目内容
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是( )
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是( )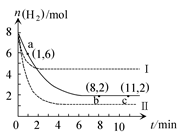
| A.反应开始至a点时v(H2)=1 mol·L-1·min-1 |
| B.若曲线Ⅰ对应的条件改变是升温,则该反应ΔH>0 |
| C.曲线Ⅱ对应的条件改变是降低压强 |
| D.T ℃时,该反应的化学平衡常数为0.125 |
A
解析

 互动英语系列答案
互动英语系列答案体积相同的密闭容器中均充入1 mol X和1mol Y,分别于300℃和500℃开始发生反应: X(g)+Y(g) 3Z(g),Z的含量(Z%)随时间t的变化如下图所示。
3Z(g),Z的含量(Z%)随时间t的变化如下图所示。
已知在t3时刻改变曲线b某一实验条件,下列判断正确的是
| A.曲线a是500℃时的图像 |
B.从0到t1时刻,反应物X(g)的 |
C.t2时刻生成物Z的量 |
| D.t3时刻改变的条件可能是降温 |
在一定条件下,CO(g)和H2(g)发生反应:CO(g) + 2H2(g)  CH3OH(g) △H=akJ/mol在容积固定的2L密闭容器中充入2mol CO(g)和4molH2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表:
CH3OH(g) △H=akJ/mol在容积固定的2L密闭容器中充入2mol CO(g)和4molH2(g)发生反应,测定在不同温度、不同时段下CO的转化率如下表: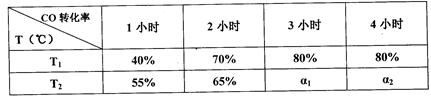
下列说法中正确的是
| A.热化学方程式中a>0 |
| B.T1℃下,在第一小时内用H2表示的化学反应速率为0.4mol/(L.h) |
| C.T1℃下,该反应的化学平衡常数为25 |
| D.T2℃下,ɑ1=ɑ2﹥80% |
己知反应A(g) + B(g)  C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g) + D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
A.达到平衡后,B的转化率为50%
B.增大压强,正、逆反应速率均加快
C.该反应为吸热反应,升高温度,平衡正向移动
D.反应初始至平衡,A的平均反应速率v(A) = 0.005 mol·L-1·s-1
纳米是长度单位,1纳米等于1×10-9 m,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是( )
| A.常温下“纳米铜”比铜片的金属性强,反应时反应速率快 |
| B.常温下“纳米铜”比铜片更易失电子,反应时反应速率快 |
| C.常温下“纳米铜”的还原性大于铜片的还原性 |
| D.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
在2NO2(红棕色) N2O4(无色)的可逆反应中,下列状态一定属于平衡状态的是( )。
N2O4(无色)的可逆反应中,下列状态一定属于平衡状态的是( )。
| A.N2O4和NO2的分子数比为1∶2 |
| B.N2O4和NO2的浓度相等 |
| C.平衡体系的颜色不再改变 |
| D.单位时间内有1 mol N2O4变为NO2的同时,有1 mol NO2变为N2O4 |
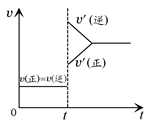
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g) ΔH<0,当达到平衡后,t1时刻改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )
2HI(g) ΔH<0,当达到平衡后,t1时刻改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )
| A.容器内气体的颜色变深,混合气体的密度增大 |
| B.平衡不发生移动 |
| C.I2(g)转化率增大,HI平衡浓度变小 |
| D.改变条件前后,速率图像如图所示 |
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g) Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是 ( )
Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是 ( )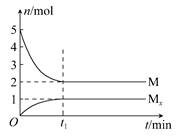
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时,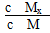 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |