题目内容
【题目】盐酸与大理石反应制备二氧化碳时,不能使反应速率明显加快的是
A.块状大理石敲碎B.盐酸的浓度增加一倍
C.盐酸的用量增加一倍D.温度升高10℃
【答案】C
【解析】
A选项,块状大理石敲碎,增大反应物接触面积,反应速率加快,故A能;
B选项,盐酸的浓度增加一倍,增大溶液中氢离子浓度,反应速率加快,故B能;
C选项,盐酸的用量增加一倍,浓度没有改变,只是改变了溶液的体积,反应速率不变,故C不能;
D选项,温度升高10℃,升高温度,反应速率加快,故D能;
综上所述,答案为C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程: 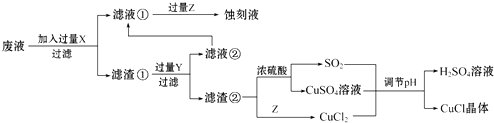
根据以上信息回答下列问题:
(1)生产过程中X的化学式为 .
(2)写出产生CuCl的化学方程式: .
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由 . 实际生产中SO2要适当过量,原因可能是(答一点即可).
(4)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为 , 当pH较大时CuCl产率变低原因是 . 调节pH时,(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是 .
(5)氯化亚铜的定量分析: ①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解.
②用0.10molL﹣1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+ . 三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为(结果保留三位有效数字).

