题目内容
【题目】工业上以乙苯催化脱氢制取苯乙烯的反应如下: ![]() (g)
(g) ![]()
![]() (g)+H2(g)
(g)+H2(g)
现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定.在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示.
已知:气体分压(p分)=气体总压(p总)×体积分数.
不考虑副反应,下列说法正确的是( )
A.400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低
B.500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动
C.550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= ![]() ×p总
×p总
D.550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍
【答案】C
【解析】解:A、向体积可变的密闭容器中通入水蒸气,导致反应体系体积变大,反应物和生成的浓度都减小,v(正)、v(逆) 均减小,相当于减小压强,平衡正向移动,所以乙苯转化率升高,故A错误;B、向体系中通入乙苯、苯乙烯、氢气各0.1x mol,相当于减小压强,平衡正向移动,而不是不移动,故B错误;
C、由图可知500℃时,乙苯的平衡转化率为:60%,应用三行式,
|
|
| H2(g) | |
初起量: | x mol | 0 | 0 | |
变化量: | 0.6xmol | 0.6xmol | 0.6xmol | |
平衡量: | 0.4xmol | 0.6xmol | 0.6xmol |
所以K= 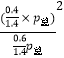 =
= ![]() ×p总 , 故C正确;
×p总 , 故C正确;
D、由图可知550℃时平衡体系中苯乙烯的转化率率为:60%,450℃时平衡体系中苯乙烯的转化率率为:20%,所以550℃时平衡体系中苯乙烯的体积分数是450℃时的2倍,故D错误;
故选C.

【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH,CO,H2的浓度都不再发生变化
E.容器中气体的压强不再改变
(2)表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①写出该反应的平衡常数K的表达式
②由表中数据判断该反应的△H0(填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,5min时达到平衡,测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 , 在0~5min内,以H2表示的平均反应速率为molL﹣1min﹣1 , 平衡时CH3OH的浓度为molL﹣1


