题目内容
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
则CO(g)+2H2(g)![]() CH3OH(g) ΔH=__kJ·mol-1
CH3OH(g) ΔH=__kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是__(填写序号)。
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
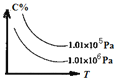
(3)在一定压强下,容积为V L的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1__p2(填“大于”、“小于”或“等于”);
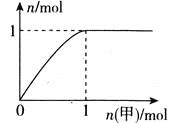
②100℃时,该反应的化学平衡常数K=__(mol·L-1)-2;
③在其它条件不变的情况下,再增加amolCO和2amolH2,达到新平衡时,CO的转化率__(填“增大”、“减小”或“不变”)。
【答案】-90.1 ac 小于 ![]() 增大
增大
【解析】
(1)用CO可以合成甲醇。由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)CH3OH(g);
(2)温度越高、压强越大,使用催化剂都可使反应速率增大,降低温度反应速率减慢,从体系中分离出甲醇,相当于减少浓度,反应速率减慢;
(3)①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)CH3OH(g)可知压强越大,越有利于平衡向正反应进行,故压强P1<P2;
②由于平衡常数与压强没有关系,所以根据图象可知,在100℃P1时,CO的转化率是0.5,通过反应方程式和公式K=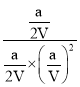 可以求得;
可以求得;
③在其它条件不变的情况下,再增加a molCO与2amolH2,等效为增大压强,平衡向正反应移动,CO转化率增大;
(1)(1)用CO可以合成甲醇。已知:①CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;②CO(g)+
O2(g)=CO2(g)+2H2O(l)△H=-764.5kJmol-1;②CO(g)+ ![]() O2(g)=CO2(g)△H=-283.0kJmol-1;③H2(g)+
O2(g)=CO2(g)△H=-283.0kJmol-1;③H2(g)+ ![]() O2(g)=H2O(l)△H=-285.8kJmol-1;由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)CH3OH(g)△H=-283.0kJ/mol-285.8kJ/mol×2+764.5kJ/mol=-90.1kJ/mol,故答案为:-90.1;
O2(g)=H2O(l)△H=-285.8kJmol-1;由盖斯定律可知,②+③×2-①得到CO(g)+2H2(g)CH3OH(g)△H=-283.0kJ/mol-285.8kJ/mol×2+764.5kJ/mol=-90.1kJ/mol,故答案为:-90.1;
(2)温度越高、压强越大,使用催化剂都可使反应速率增大,降低温度反应速率减慢,从体系中分离出甲醇,相当于减少浓度,反应速率减慢,故答案为:ac;
(3)①由图1可知,温度相同时,在压强为P2时平衡时CO的转化率高,由反应CO(g)+2H2(g)CH3OH(g)可知压强越大,越有利于平衡向正反应进行,故压强P1<P2,故答案为:小于;
②由于平衡常数与压强没有关系,所以根据图象可知,在100℃P1时,CO的转化率是0.5,则
CO(g)+2H2(g)=CH3OH(g)
起始浓度(mol/L)![]()
![]() 0
0
转化浓度(mol/L)![]()
![]()
![]()
平衡浓度(mol/L)![]()
![]()
![]()
所以平衡常数K=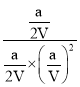 =
=![]() ,
,
故答案为: ![]() ;
;
③在其它条件不变的情况下,再增加a molCO与2amolH2,等效为增大压强,平衡向正反应移动,CO转化率增大,故答案为:增大;

 名校课堂系列答案
名校课堂系列答案