题目内容
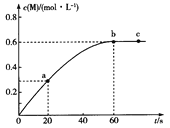
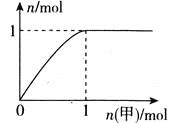
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,R-和Y+的简单离子相差8个电子。甲、乙化合物均含上述四种元素;常温下,0.01molL-1甲溶液的pH=2,0.01molL-1乙溶液的pH=a(2<a<7)。向乙溶液中滴加甲溶液,产生气体的物质的量与甲的物质的量关系如图所示(假设气体全部排出)。下列说法不正确的是( )
A.简单的离子半径:Z>X>Y
B.简单气态氢化物的热稳定性:X>Z
C.甲、乙中均含有离子键和共价键
D.常温下,甲、乙溶液中由水电离出的H+和OH-之间存在:c(H+)水c(OH-)水=1.0×10-14
【答案】D
【解析】
短周期主族元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,![]() 和
和![]() 的简单离子相差8个电子,所以R是氢元素,Y是钠元素,甲、乙化合物均含上述四种元素,说明两种物质均为钠盐,0.01molL-1甲溶液的
的简单离子相差8个电子,所以R是氢元素,Y是钠元素,甲、乙化合物均含上述四种元素,说明两种物质均为钠盐,0.01molL-1甲溶液的![]() ,0.01molL-1乙溶液的pH范围是:
,0.01molL-1乙溶液的pH范围是:![]() ,说明甲是强酸的酸式盐,乙是弱酸的酸式盐,综上说明甲是硫酸氢钠,乙是亚硫酸氢钠,四种元素分别是氢、氧、钠、硫。
,说明甲是强酸的酸式盐,乙是弱酸的酸式盐,综上说明甲是硫酸氢钠,乙是亚硫酸氢钠,四种元素分别是氢、氧、钠、硫。
A. 简单的离子半径:硫离子大于氧离子大于钠离子,即![]() ,故A正确;
,故A正确;
B. 气态氢化物的热稳定性:水大于硫化氢,即![]() ,故B正确;
,故B正确;
C. 亚硫酸氢钠与硫酸氢钠溶液中都存在离子键和共价键两种化学键,故C正确;
D. 常温下甲、乙溶液中水的电离受到抑制,![]() ,故D错误。
,故D错误。
综上所述,答案为D。

【题目】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
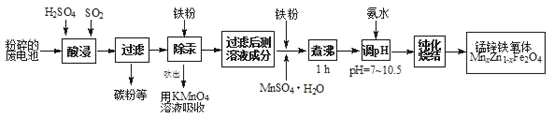
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
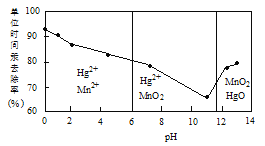
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)