题目内容
17.11.0g 由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O组成的水分子,其中含中子数为6mol,电子数为5mol.分析 根据n=$\frac{m}{M}$计算水的物质的量,结合分子含有含有中子数、电子数计算中子、电子的物质的量,再根据N=nNA计算电子数目.
解答 解:由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O组成的水分子的相对分子质量为22,则11g的物质的量为$\frac{11g}{22g/mol}$=0.5mol,其中含中子数为(2×1+18-8)×0.5mol=6mol,电子数为(2×1+8)×0.5mol=5mol,
故答案为:6;5.
点评 本题考查物质的量的计算以及原子结构,侧重于学生的分析能力和计算能力的考查,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
8.下列有关物质用途的说法中,不正确的是( )
| A. | Fe2O3常用于制造红色油漆和涂料 | |
| B. | 明矾能够消毒杀菌是利用了胶体的吸附性 | |
| C. | 氧化铝可用来制造耐高温的实验仪器 | |
| D. | 二氧化硅可用于制造光导纤维 |
5.现有下列九种物质:
①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(每空一分):
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)将②加入NaOH的溶液中反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(每空一分):
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ④ | ③⑤⑥⑨ |
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)将②加入NaOH的溶液中反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
12. 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
可能大量含有的阳离子H+、Ag+、Mg2+、Al3+、NH4+、Fe3+
可能大量含有的阴离子CO32-、AlO2-、NO3-
为探究其成分,进行了以下实验:
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
下列说法中错误的是( )
 某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.
某混合溶液中,一定含有Cl-、Br-、I-,可能含有的离子如下表所示.可能大量含有的阳离子H+、Ag+、Mg2+、Al3+、NH4+、Fe3+
可能大量含有的阴离子CO32-、AlO2-、NO3-
为探究其成分,进行了以下实验:
探究一:取10mL该混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示.
探究二:取1L该混合溶液,向该溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示.
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n(Br-) | 3.0mol | 2.8mol | 1.8mol |
| n(I-) | X mol | 0 | 0 |
| A. | X=0.3 | |
| B. | 溶液中n(Cl-):n(Br-):n(I-)=10:15:4 | |
| C. | 加入的氢氧化钠溶液的浓度为1.45mol•L-1 | |
| D. | 溶液中大量存在的离子共有六种 |
9.下列变化,需要加入适当的还原剂才能实现的( )
| A. | HCl→Cl2 | B. | H2S→SO2 | C. | Fe2O3→Fe | D. | CaO→Ca(OH)2 |
2.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化.为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得
S2Cl2粗品.
②有关物质的部分性质如下表:
设计实验装置图如下:
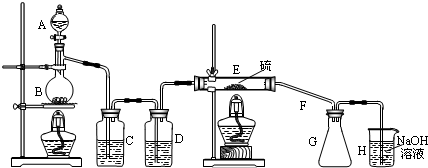
(1)E中反应的化学方程式2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
(2)C、D中的试剂分别是饱和食盐水、浓硫酸(填试剂名称).
(3)F的作用是导气、冷凝.
(4)如果在加热E时温度过高,对实验结果的影响是产率降低(或S2Cl2分解),在F中可能出现的现象是有黄色固体生成.
(5)S2Cl2粗品中可能混有的杂质是(填写两种)SCl2、Cl2或S,为了提高S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不要过快.
①将干燥的氯气在110℃~140℃与硫反应,即可得
S2Cl2粗品.
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl,SO2,S2,300℃以上万全分解: S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2SCl2 |

(1)E中反应的化学方程式2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
(2)C、D中的试剂分别是饱和食盐水、浓硫酸(填试剂名称).
(3)F的作用是导气、冷凝.
(4)如果在加热E时温度过高,对实验结果的影响是产率降低(或S2Cl2分解),在F中可能出现的现象是有黄色固体生成.
(5)S2Cl2粗品中可能混有的杂质是(填写两种)SCl2、Cl2或S,为了提高S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不要过快.
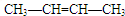 或
或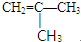 .
.