题目内容
6.同主族元素(1)碱金属元素(按Li、Na、K的顺序)性质的递变规律:
①金属性逐渐增强,表现在:单质与O2反应的产物越来越复杂,反应程度越来越剧烈;单质与水(或酸)反应的程度逐渐增强;最高价氧化物对应水化物的碱性逐渐增强.
②单质的密度逐渐增大(K或钾特殊),熔、沸点逐渐降低.
(2)卤族元素(按F、Cl、Br、I的顺序)性质的递变规律:
①非金属性逐渐减弱,表现在:单质与氢气化合由易到难的顺序:F2>Cl2>Br2>I2;气态氢化物的稳定性顺序:HF>HCl>HBr>HI;最高价氧化物对应水化物的酸性顺序:HClO4>HBrO4>HIO4;
②单质的颜色逐渐加深,密度逐渐增大,熔、沸点逐渐升高.
分析 依据同主族元素性质递变规律解答:
碱金属元素,金属性从上到下依次增加,单质还原性依次增强,与水反应剧烈程度增强,最高价氧化物对应水化物碱性依次增强,单质密度依次增大(钾反常),熔沸点依次降低;
卤族元素,从上到下,非金属依次减弱,单质与氢气化和越来越难,气体氢化物稳定性依次减弱,最高价氧化物对应水化物酸性依次减弱,单质颜色逐滴加深,密度逐渐增大,熔沸点逐渐升高.
解答 解:(1)①碱金属元素,金属性从上到下依次增加,单质还原性依次增强,单质与O2反应的产物越来越复杂,反应程度越来越剧烈,单质与水(或酸)反应的程度逐渐增强,最高价氧化物对应水化物的碱性逐渐增强;
故答案为:增强;复杂;剧烈;增强;增强;
②碱金属元素,从上到下,单质的密度逐渐增大,钾反常,金属键从上到下依次减弱,所以),熔、沸点逐渐降低;
故答案为:K或钾;降低;
(2)①卤族元素,从上到下,非金属依次减弱,单质与氢气化和越来越难,单质与氢气化合由易到难的顺序:F2>Cl2>Br2>I2;
气体氢化物稳定性依次减弱,气态氢化物的稳定性顺序:HF>HCl>HBr>HI;,最高价氧化物对应水化物酸性依次减弱,高价氧化物对应水化物的酸性顺序:HClO4>HBrO4>HIO4;
故答案为:F2>Cl2>Br2>I2;HF>HCl>HBr>HI;HClO4>HBrO4>HIO4;
②卤族元素,从上到下,单质的颜色逐渐加深,密度逐渐增大,熔、沸点逐渐升高,
故答案为:加深;增大;升高.
点评 本题考查了碱金属、卤族元素性质,熟悉同主族元素性质的递变规律是解题关键,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
6.在能使酚酞变红的无色溶液中,可大量共存的离子组是( )
| A. | Na+、Cu2+、Br-、Cl- | B. | K+、NH4+、Cl-、Na+ | ||
| C. | K+、Na+、NO3-、H+ | D. | K+、S2-、SO42-、OH- |
17.将下列各组物质按酸、碱、盐分类依次排列,正确的是( )
| A. | 硫酸、纯碱、石膏 | B. | 硫酸、烧碱、胆矾 | ||
| C. | 硫酸氢钠、生石灰、醋酸钠 | D. | 磷酸、熟石灰、苛性钠 |
14.下列叙述中正确的是( )
①Na2O和Na2O2都能和水反应生成碱,它们都是碱性氧化物 ②Na2CO3和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 ③钠在常温下不容易被氧化 ④Na2O2可作供氧剂,而Na2O不行 ⑤除去Na2CO3固体中混有的NaHCO3,将混合物加热至质量不再发生变化 ⑥可用玻璃棒蘸取少量待测物质的浓溶液做焰色反应实验.
①Na2O和Na2O2都能和水反应生成碱,它们都是碱性氧化物 ②Na2CO3和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 ③钠在常温下不容易被氧化 ④Na2O2可作供氧剂,而Na2O不行 ⑤除去Na2CO3固体中混有的NaHCO3,将混合物加热至质量不再发生变化 ⑥可用玻璃棒蘸取少量待测物质的浓溶液做焰色反应实验.
| A. | ②③④⑤ | B. | ④⑤ | C. | ②④⑥ | D. | ①②⑥ |
1.下列气体用向下排空气法收集的是( )
| A. | NO2 | B. | SO2 | C. | O2 | D. | NH3 |
18.下列有机物的命名正确的是( )
| A. | 2,4,5-三甲基己烷 | B. | 2,3 ___二甲基丁烷 | ||
| C. | 3,3,5,5-四甲基戊烷 | D. | 2,3-二甲基-2-乙基丁烷 |
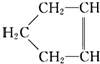 可简写为
可简写为 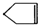 .降冰片烯的分子结构可表示为
.降冰片烯的分子结构可表示为
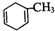 .
.