题目内容
【题目】短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,B为地壳中含量最多的元素,C是原子半径最大的短周期主族元素,C与D形成的离子化合物CD是常用的调味品。填写下列空白:
(1)A的基态原子的电子排布式为_________________;
(2)C元素在周期表中的位置是____________________
(3)B、C组成的一种化合物与水发生反应生成气体,其化学方程式为:_________。
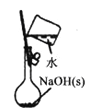
(4)如图所示,电解质a溶液为含有CD的饱和溶液。X为石墨电极,Y为铁电极,接通直流电源。
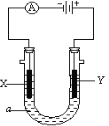
X电极的电极反应式为___________,电解池总反应的离子方程式为:_________。
【答案】1s22s22p2 第三周期IA族 2Na2O2+2H2O=4NaOH +O2↑ 2H++2e-=H2↑ 2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
【解析】
短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,最外层最多含有8个电子,则A含有2个电子层,最外层含有4个电子,A为C元素;B为地壳中含量最多的元素,则B为O元素;C是原子半径最大的短周期主族元素,则C为Na元素;C与D形成的离子化合物CD是常用的调味品,CD为NaCl,则D为Cl元素,据此解答。
根据上述分析可知,A为C元素、B为O元素、C为Na元素、D为Cl元素。
(1)A是C元素,C的原子序数为6,根据构造原理可知基态C原子的电子排布式为1s22s22p2,故答案为:1s22s22p2;
(2)C元素为Na元素,钠原子核外有3个电子层,最外层有1个电子,则Na在周期表中的位置时第三周期IA族,故答案为:第三周期IA族;
(3)B、C组成的一种化合物与水发生反应放出气体,则该化合物为Na2O2,过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(4)电解质a溶液为含有NaCl的饱和溶液,X为石墨电极,与电源负极相连,作阴极,阴极X电极上发生还原反应,电极反应式为:2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);电极Y为铁电极,与直流电源正极相连,发生氧化反应,Y电极的电极反应式为:Fe-2e-=Fe2+,电解池总反应的离子方程式为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,故答案为:2H++2e-=H2↑;2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2H++2e-=H2↑;2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。

 阅读快车系列答案
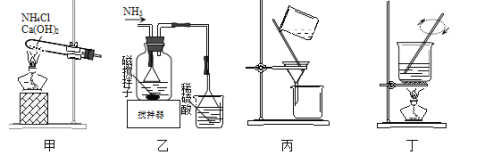
阅读快车系列答案【题目】碱式氯化镁(MgOHCl)常用作塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创。某中学科研小组根据该原理设计如下装置图进行相关实验,装置C中CuO的质量为8.0g。
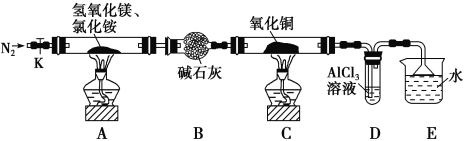
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:______________。
(2)装置D中生成沉淀,发生反应的离子方程式为___________________。
(3)反应过程中持续通入N2的作用有两点:一是:将装置A中产生的氨气完全导出,二是:_______________________。
(4)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,该反应中转移电子的物质的量为_______mol。
(5)请你设计一个实验方案证明装置C中的氧化铜反应完全后得到的红色固体中含有氧化亚铜。已知:①Cu2O+2H+=Cu2++Cu+H2O
②限选试剂:2 mol·L-1H2SO4溶液、浓硫酸、2 mol·L-1HNO3溶液、10 mol·L-1 HNO3溶液
实验步骤 | 预期现象和结论 |
步骤1:取反应后装置C中的少许固体于试管中 | |
步骤2:______________________________ | _____________________ |