题目内容
(10分)胆矶(CuSO4•5H20)广泛用于电镀工艺,在医药上用做收敛剂、防腐剂和催吐剂。以下是用铜粉氧化法生产胆矾的流程图:
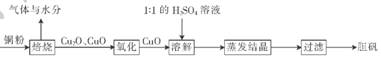
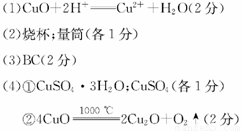
(1 )写出溶解过程中发生反应的离子方程式:____________
(2)1 :1的H2SO4溶液是由l体积98%的H2SO4与1体积水混合而成。配制该硫酸所需的硅酸盐质仪器除玻璃棒外.还需要______、______。
(3)已知氧化亚铜(Cu2O)与稀H2SO4反应有CuSO4和Cu生成。假设焙烧后固体只含铜的氧化物.为检验该固体的成分.下列实验设计合理的是__________________(填字母)。
A. 加人稀H2SO4,若溶液呈蓝色,说明固体中一定有CuO
B. 加人稀H2SO4,若有红色沉淀物生成,说明固体中一定有Cu2O
C. 加人稀HNO3,若有无色气体(随即变成红棕色:)产生,说明固体中有Cu2O
D. 加人稀HNO3,若固体全部溶解,说明固体中没有Cu2O
(4)取2.50g胆矶样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。
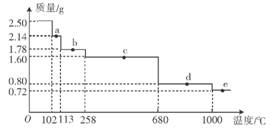
①a点时固体物质的化学式为______,c点时固体物质的化学式为______。
②10000C时发生反应的化学方程式为_________________________
【解析】略

(10分)胆矶(CuSO4?5H20)广泛用于电镀工艺,在医药上用做收敛剂、防腐剂和催吐剂。以下是用铜粉氧化法生产胆矾的流程图: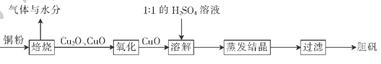
(1 )写出溶解过程中发生反应的离子方程式:____________
(2)1:1的H2SO4溶液是由l体积98%的H2SO4与1体积水混合而成。配制该硫酸所需的硅酸盐质仪器除玻璃棒外.还需要______、______。
(3)已知氧化亚铜(Cu2O)与稀H2SO4反应有CuSO4和Cu生成。假设焙烧后固体只含铜的氧化物.为检验该固体的成分.下列实验设计合理的是__________________(填字母)。
| A.加人稀H2SO4,若溶液呈蓝色,说明固体中一定有CuO |
| B.加人稀H2SO4,若有红色沉淀物生成,说明固体中一定有Cu2O |
| C.加人稀HNO3,若有无色气体(随即变成红棕色:)产生,说明固体中有Cu2O |
| D.加人稀HNO3,若固体全部溶解,说明固体中没有Cu2O |
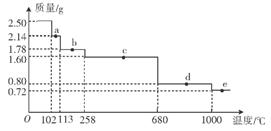
①a点时固体物质的化学式为______,c点时固体物质的化学式为______。
②10000C时发生反应的化学方程式为_________________________