题目内容
【题目】298K、1.01×105Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式正确的是

A. Se(s)+ H2(g) = H2Se(g) ΔH=-242kJ·mol-1
B. Se(s)+ H2(g) = H2Se(g) ΔH=-20kJ·mol-1
C. Se(g)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
D. Se(s)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
【答案】D
【解析】能量越低越稳定,H2O、H2S、H2Se、H2Te稳定性减弱,所以b表示Te与H2化合的反应热数据,故AB错误;Se是固体,所以Se与H2化合的热化学反应方程式是Se(s)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1,故C错误、D正确;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验:
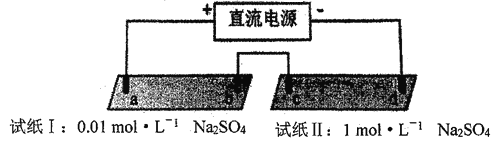
实验现象:
时间 | 试纸I | 试纸II |
lmin | a极附近试纸变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近…… |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
下列说法不正确的是
A. d极附近试纸变蓝
B. a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH-
C. 对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移
D. 试纸I的现象说明,此环境中H+的迁移速率比OH-快