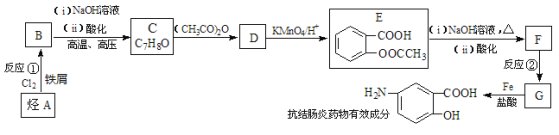
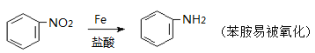
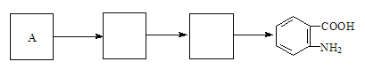
��Ŀ����
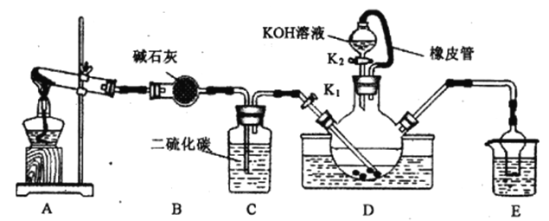
����Ŀ�����մ�Na2S2O35H2O�����մ��С�մ�Ϊ�մ����ֵܣ������������������й㷺��Ӧ�á�
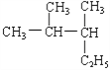
��1����ҵ�ϣ���̼���ƺ����������ʵ���1:2��������Һ����ͨ��SO2����ȡNa2S2O3��ͬʱ�ų�CO2��д���˷�Ӧ�Ļ�ѧ��Ӧ����ʽ___��������Һ�ڿ����о��û���ֵ���ɫ���ʣ����ⶨ�����ʾ���������������ƵĽṹ�������ʵĵ���ʽΪ��___��
��2��Na2S2O3����Һ�����ڵζ�I2�ĺ��������ζ���Һ�����Իᵼ�²ⶨ���ƫ�ߣ������ӷ���ʽ������ԭ��____��
��3����ҵ�ϳ��ô��մ���Һ���չ�ҵβ���е�Cl2������������ΪSO42-����д�������ӷ���ʽ��___��������һ���Լ����Լ��÷�Ӧ�Ƿ��ѷ�����Ӧ����___��
A.AgNO3+HNO3(ϡ) B.BaCl2+HCl C.Ʒ��+H2SO4(ϡ) D.HCl+����ʯ��ˮ
��4�����ܱ�������Ͷ��һ������Na2O2��NaHCO3��300���³�ַ�Ӧ������������Ϊ���������ʼʱn(NaHCO3)/n(Na2O2)�������������Ϊ___��
���𰸡�Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2 ![]() S2O32-+2H+=S��+SO2��+H2O S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ B ��2
S2O32-+2H+=S��+SO2��+H2O S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ B ��2
��������
(1)������ɿ�֪Na2CO3��Na2S��1:2�����ʵ���֮�Ȼ�ϣ���ͨ�������������Ӧ����Na2S2O3�Ͷ�����̼������ԭ�Ӹ����غ㡢��ʧ�����غ���д����ʽ�����ݹ������ƽṹ�����ԭ�ӡ���ԭ�ӽṹ���
(2)���Ի�����S2O32-�����绯��Ӧ�����ĵ�����������ƫ�࣬�ⶨ�����ƫ�ߣ�
(3)��ҵ���ô��մ���Һ���չ�ҵ�����е�����������������ΪSO42-�����ӷ�Ӧ����ʽΪ��S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+��ֻҪ������Һ�к���SO42-����˵����Ӧ�Ѿ�������
(4)Na2O2��������NaHCO3��Ϻ����ܱ������г�ּ��ȣ����ܷ����ķ�Ӧ�У�2NaHCO3 ![]() Na2CO3+CO2��+H2O��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����CO2+2NaOH=Na2CO3+H2O����������Ϊ�������Ϊ̼���ƣ��ɴ˷������
Na2CO3+CO2��+H2O��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����CO2+2NaOH=Na2CO3+H2O����������Ϊ�������Ϊ̼���ƣ��ɴ˷������
(1)������ɿ�֪Na2CO3��Na2S��1:2�����ʵ���֮�Ȼ�ϣ���ͨ�������������Ӧ����Na2S2O3�Ͷ�����̼����Ӧ��SԪ�صĻ��ϼ۴�-2�����ߵ�+2�ۣ�S�Ļ��ϼ۴�+4�۽��͵�+2�ۣ�����ԭ�Ӹ����غ㡢��ʧ�����غ㷴Ӧ�ķ���ʽ��2Na2S+Na2CO3+4SO2��3Na2S2O3+CO2��Na2S��Һ�ڿ����г��ڷ��ã���������Ӧ������������ƵĽṹ����ѧ�������Ƶ�����Na2S2�������ʽΪ![]() ��
��
(2)���Ի�����S2O32-�����绯��Ӧ�����ӷ���ʽ��S2O32-+2H+=S��+H2O+SO2����
(3)��ҵ���ô��մ���Һ���չ�ҵ�����е�����������������ΪSO42-�����ӷ�Ӧ����ʽΪ��S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+������Һ�еμ�ϡ�����ữ���ٵμ�BaCl2��Һ���а�ɫ�������ɣ�˵����Һ�к���SO42-����֤����Ӧ�Ѿ��������ʴ�ΪB��
(4)Na2O2��������NaHCO3��Ϻ����ܱ������г�ּ��ȣ����ܷ����ķ�Ӧ�У�2NaHCO3![]() Na2CO3+CO2��+H2O��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����CO2+2NaOH=Na2CO3+H2O����������Ϊ�������Ϊ̼���ƣ���n(NaHCO3)��n(Na2O2)��2��
Na2CO3+CO2��+H2O��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����CO2+2NaOH=Na2CO3+H2O����������Ϊ�������Ϊ̼���ƣ���n(NaHCO3)��n(Na2O2)��2��