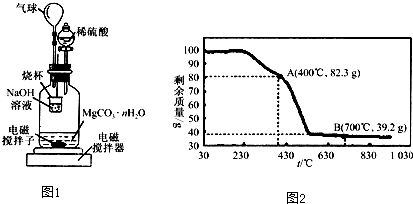
题目内容
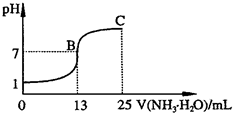
将氨水逐滴加入到稀盐酸中,使溶液为中性,则此时( )
分析:混合溶液呈中性,则[H+]=[OH-],结合电荷守恒判断氢根离子和氯离子浓度相对大小.
解答:解:混合溶液呈中性,则[H+]=[OH-],溶液呈电中性,所以溶液中阴阳离子所带电荷相等,即[H+]+[NH4+]=[Cl-]+[OH-],所以[NH4+]=[Cl-],
故选:C.
故选:C.
点评:本题考查了酸碱混合溶液定性判断,根据溶液的酸碱性及电荷守恒分析解答即可,难度不大.

练习册系列答案
相关题目
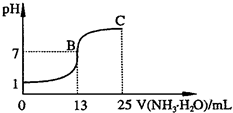 (2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.
(2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.