题目内容
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
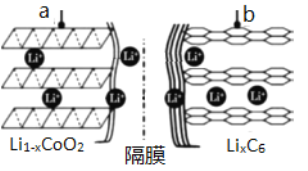
①充电时,a极的电极反应式为____________________________________。
②放电时,电流从______(填“a”或“b”)极流出。
(2)钴酸锂回收再生流程如下:

①H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是_______________。
②用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是:会产生有毒、有污染的气体。写出相应反应的化学方程式______________________________。
③高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为_______________。
(3)已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式_____________________________。
【答案】LiCoO2-xe-=Li1-xCoO2 +xLi+ a 还原LiCoO2(将LiCoO2中的+3价Co还原为Co2+) 2LiCoO2 +8HCl=2LiCl+2CoCl2 + Cl2↑+4H2O 4CoC2O4+2Li2CO3+3O2![]() 4LiCoO2 +10CO2 FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1或3FeO(s)+3CO(g)===3Fe(s)+3CO2(g) ΔH=-33 kJ·mol-1
4LiCoO2 +10CO2 FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1或3FeO(s)+3CO(g)===3Fe(s)+3CO2(g) ΔH=-33 kJ·mol-1
【解析】
(1) 由题给信息可知充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,放电时a为正极,发生还原反应生成LiCoO2,b为负极,Li被氧化生成离子;
(2) 由流程可知,钴酸锂滤渣用稀硫酸酸浸,滤液含有钴离子、锂离子,加入草酸,可生成CoC2O4,含锂离子的溶液加入碳酸钠生成碳酸锂,与CoC2O4在高温下反应生成LiCoO2,以此解答该题。
(3) 首先写出FeO(s)被CO还原成Fe和CO2的热化学方程式CO(g)+FeO(s)=Fe(g)+CO2(g)△H,利用盖斯定律①×3-(③×2+②)可得到该化学方程式。
(1) 充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,放电时a为正极,发生还原反应生成LiCoO2,b为负极,Li被氧化生成离子;
①充电时,a极为阳极,发生氧化反应,则电极反应式为LiCoO2-xe-=Li1-xCoO2 +xLi+;
②放电时,电流从正极流出,即从a极流出。
(2)①添加30% 的H2O2,生成钴离子,可知过氧化氢起到还原剂的作用,还原LiCoO2;
②由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,且引入氯离子杂质,在后续步骤中难以分离,反应的方程式为2LiCoO2+8HCl=2LiCl+2CoCl2+Cl2↑+4H2O;
③高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2,同时有CO2生成,发生反应的化学方程式为4CoC2O4+2Li2CO3+3O2![]() 4LiCoO2 +10CO2;
4LiCoO2 +10CO2;
(3) ①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol,②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol,③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol,依据盖斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66kJ/mol,则FeO(s)被CO还原成Fe和CO2的热化学方程式为FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1或3FeO(s)+3CO(g)===3Fe(s)+3CO2(g) ΔH=-33 kJ·mol-1。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案