题目内容
今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变,片刻后,甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计) …( )
| A.甲=乙>丙 | B.甲>丙>乙 | C.丙>甲=乙 | D.乙>丙>甲 |
B
氯水中存在下列平衡:Cl2+H2O HCl+HClO,加入NaHCO3后,因为酸性:HCl>H2CO3>HClO,所以NaHCO3与HCl反应而不与HClO反应,平衡向右移动,HClO浓度增大,又因HClO具有强氧化性,可将NaHSO3氧化,从而使HClO浓度下降。
HCl+HClO,加入NaHCO3后,因为酸性:HCl>H2CO3>HClO,所以NaHCO3与HCl反应而不与HClO反应,平衡向右移动,HClO浓度增大,又因HClO具有强氧化性,可将NaHSO3氧化,从而使HClO浓度下降。
点评:本题发生错解的原因是:不清楚酸性H2CO3>HClO,在加NaHCO3时误认为HClO与NaHCO3反应,得出甲中HClO的物质的量也在减少的结论。
 HCl+HClO,加入NaHCO3后,因为酸性:HCl>H2CO3>HClO,所以NaHCO3与HCl反应而不与HClO反应,平衡向右移动,HClO浓度增大,又因HClO具有强氧化性,可将NaHSO3氧化,从而使HClO浓度下降。
HCl+HClO,加入NaHCO3后,因为酸性:HCl>H2CO3>HClO,所以NaHCO3与HCl反应而不与HClO反应,平衡向右移动,HClO浓度增大,又因HClO具有强氧化性,可将NaHSO3氧化,从而使HClO浓度下降。点评:本题发生错解的原因是:不清楚酸性H2CO3>HClO,在加NaHCO3时误认为HClO与NaHCO3反应,得出甲中HClO的物质的量也在减少的结论。

练习册系列答案
相关题目

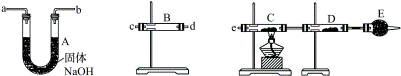
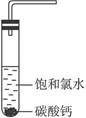
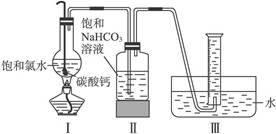
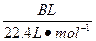 明显小于
明显小于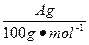 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。