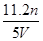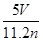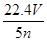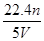题目内容
配制250 mL 0.5 mol·L-1的NaOH溶液,在下列仪器中:①量筒 ②250 mL容量瓶 ③托盘天平和砝码 ④500 mL容量瓶 ⑤烧杯 ⑥玻璃棒 ⑦漏斗 ⑧药匙 ⑨胶头滴管
⑩250 mL的烧瓶,需要用到的仪器按使用先后顺序排列正确的是
| A.⑧③⑤⑥②⑨ | B.②③⑦⑤⑥ |
| C.②⑤⑦⑥① | D.④③⑦⑤⑥ |
A
解析试题分析:本题只需一步即可选出答案,在用固体配置溶液时,首先要用药匙取所需药品,然后用托盘天平称量,用烧杯、玻璃棒溶解,再选择一定规格的容量瓶,最后用胶头滴管定容,而选项中只有A符合,因此答案选A。B、C、D均错。
考点:考查配制一定浓度的溶液的实验步骤

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是
| A.1 mol H2O的质量为18g·mol-1 |
| B.质量数为37的氯原子 17 37Cl |
| C.3.01×1023个SO2分子的质量为32g |
| D.标准状况下,1 mol任何物质体积均为22.4L |
配制250 mL 0.10 mol/L的NaOH溶液时,下列实验操作会使配得的溶液浓度偏小的是 ( )
| A.容量瓶未干燥就直接加水定容 |
| B.在容量瓶中进行定容时仰视刻度线 |
| C.称量的NaOH固体已潮解 |
| D.定容后把容量瓶倒转摇匀,发现液面低于刻度 |
下列叙述的两个量,一定相等的是( )
| A.质量相等的金刚石和C60中的碳原子数目 |
| B.0.1 mol/L NaCl溶液与0.05 mol/L Na2CO3溶液中所含Na+的数目 |
| C.标准状况下等体积的SO2和SO3的分子数目 |
| D.等体积pH都为3的稀盐酸与FeCl3溶液中,由水电离产生的H+数目 |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
( )
| A.20 mL 10 mol/L的浓硫酸与足量铜反应转移电子数为0.2NA |
| B.1 mol/L FeCl3溶液中Fe3+的数目小于NA |
| C.在精炼铜或电镀铜过程中,当阴极析出32 g铜时,转移电子数为NA |
| D.标准状况下,0.1NA个SO3的体积约为2.24 L |
如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定量NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)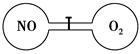
| A.开始时左右两室中的分子数相同 |
| B.反应前后左室的压强相同 |
| C.反应后容器内的密度与反应前的相同 |
| D.反应后容器内无O2存在 |
下列关于物质的量、摩尔质量的叙述正确的是( )
| A.0.012 kg 12C中含有约6.02×1023个碳原子 |
| B.1 mol H2O中含有2 mol氢和1 mol氧 |
| C.氢氧化钠的摩尔质量是40 g |
| D.2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |