题目内容
【题目】碘及其化合物在合成杀菌剂、药物、化学研究等方面具有广泛用途。
(1)为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL0.5mol·L-1 KI溶液,向其中加入0.1 mol·L-1FeCl3溶液1 mL,充分反应。下列实验操作能验证该反应是否存在限度的是___。
A.再滴加AgNO3溶液,观察是否有黄色沉淀产生
B.再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C.再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生
D.再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成血红色
(2)已知1molH2(g)、1molI2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436kJ、151kJ、 300kJ的能量,则氢气和碘蒸气反应生成HI气体的热化学方程式为_____。
(3)Bodensteins研究了下列反应:2HI(g)![]() H2(g) +I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:
H2(g) +I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 |
n(HI) | 1 | 0.91 | n |
0min到20min HI的平均反应速率为_______;
反应到达40min时,剩余HI 的物质的量____0.82mol(填“﹥” “﹤”或“=”)。
【答案】D H2(g)+I2(g)=2HI(g) △H=-13kJ/mol 0.00225mol·L-1·min-1 >
【解析】
根据可逆反应的特征分析反应是否存在反应限度;根据键能计算反应热;根据速率表达式计算反应平均速率;根据影响反应速率大小的因素分析解答。
(1)KI溶液和FeCl3溶液发生氧化还原反应生成Fe2+和I2,反应的离子方程式为2Fe3++2I-═2Fe2++I2,通过计算,I-过量;反应后的溶液中加入CCl4,如有机层呈紫红色,则说明生成碘,向含Fe3+的溶液中滴加几滴KSCN溶液呈血红色,就说明Fe3+没有反应完(或KI和FeCl3的反应有一定的限度);
A.无论是否存在反应限度,因为I-过量,滴加AgNO3溶液,都有黄色沉淀、白色沉淀生成,故A不选;
B.加入CCl4振荡后,观察下层液体颜色变为紫红色,只能说明生成碘,不能确定反应限度,故B不选;
C.因为溶液中Cl-不参加反应,取上层清液,滴加AgNO3溶液,肯定有白色沉淀,不能确定反应限度,故C不选;
D.取上层清液,滴加KSCN溶液,观察溶液是否变血红色,可知Fe3+有没有反应完,从而确定KI和FeCl3的反应有一定的限度,故D选;
(2)已知1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ;形成1molHI(g)分子需要释放300kJ的能量,则反应热为:436kJ+151kJ-300kJ×2=-13kJ,则氢气和碘蒸气反应生成HI气体的热化学方程式为:H2(g)+I2(g)=2HI(g)H=-13kJmol-1,故答案为:H2(g)+I2(g)=2HI(g)H=-13kJmol-1;
(3)v=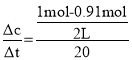 =0.00225molL-1min-1,所以后20min速率小于0.00225molL-1min-1,变化量小于0.09mol,剩余HI的物质的量>0.91-0.09mol=0.82mol,故答案为:0.00225molL-1min-1;大于。
=0.00225molL-1min-1,所以后20min速率小于0.00225molL-1min-1,变化量小于0.09mol,剩余HI的物质的量>0.91-0.09mol=0.82mol,故答案为:0.00225molL-1min-1;大于。


