题目内容
【题目】铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。
(1)还原沉淀法是处理含Cr2O72-和CrO42-工业废水的一种常用方法,其工艺流程为:
![]()
其中第Ⅰ步存在平衡:2Cr2O42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
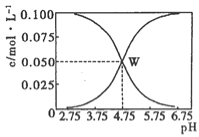
①若平衡体系的pH=0,该溶液显__________色。
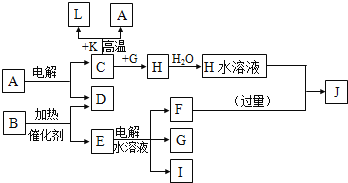
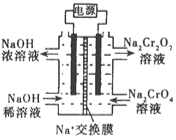
②根据 2Cr2O42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为_________,图中右侧电极连接电源的_________极,其电极反应式为_________________。
Cr2O72-(橙色)+H2O设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为_________,图中右侧电极连接电源的_________极,其电极反应式为_________________。
③第Ⅱ步反应的离子方程式:_________________________。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。完成该反应的化学方程式:
![]()
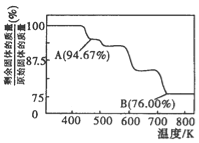
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是____________(填化学式)。
【答案】(1)①橙;②+6,正极;4OH--4e-=O2↑+2H2O;③6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
(2)4,3,6,2,3,9H2O;(3)Cr2O3.
【解析】
试题分析:(1)①若平衡体系的pH=0,溶液酸性较强,平衡2Cr2O42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O正向移动,溶液呈橙色;
Cr2O72-(橙色)+H2O正向移动,溶液呈橙色;
②由化合价代数和为0可知Na2Cr2O7中铬元素的化合价为+6价,根据2Cr2O42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O;
Cr2O72-(橙色)+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O;
③亚铁离子与Cr2O72-发生氧化还原反应,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬,铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O;
(3)设固体质量为100g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为24g,两者的个数比为![]() =2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3。
=2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案