题目内容
【题目】下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。

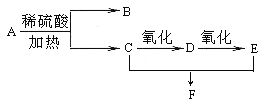
(1)上述元素中单质的熔点最高的可能是________(填名称)。
(2)比较D、G氢化物的稳定性 (用化学式表示)。
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为: ;
(4)D、E、G、H四种元素最高价含氧酸的酸性由强到弱的顺序是: (填化学式)。
(5)A、D两种元素构成的两种烃X和Y,X是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平;Y是一种比水轻的油状液体,两种元素的质量比为12∶1,Y的相对分子质量为78。
①X的结构简式 。
②Y与浓硫酸与浓硝酸在50~60℃反应的化学反应方程式: ,反应类型________。
【答案】(1)碳
(2)CH4﹥SiH4
(3)![]()
(4)HClO4﹥HNO3﹥H2CO3﹥H2SiO3
(5)①CH2=CH2
② C6H6+HNO3![]() C6H5NO2+H2O;取代反应(硝化反应)
C6H5NO2+H2O;取代反应(硝化反应)
【解析】试题分析:图中所示为元素周期表中短周期元素的一部分,根据各元素在周期表中的位置可以推知:A为氢元素、B为氦元素、C为钠元素、D为碳元素、E为氮元素、F为氧元素、G为硅元素、H为氯元素。据此可得下列结论:
(1)上述元素中单质的熔点最高的可能是碳。
故答案为:碳;
(2)元素的非金属性越强,形成气态氢化物越稳定。D为碳元素、G为硅元素,非金属性D>G,所以氢化物的稳定性CH4﹥SiH4。
故答案为:CH4﹥SiH4;
(3)A为氢元素、E为氮元素,在一定条件下,A与E可形成一种极易溶于水的气态化合物为氨气,其电子式为:![]() ;
;
故答案为:![]() ;
;
(4)元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,D为碳元素、E
为氮元素、G为硅元素、H为氯元素,非金属性: Cl﹥N﹥C﹥Si,所以四种元素最高价含氧酸的酸性由强到弱的顺序是:HClO4﹥HNO3﹥H2CO3﹥H2SiO3。
故答案为:HClO4﹥HNO3﹥H2CO3﹥H2SiO3;
(5)A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为CH2=CH2;B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,则原子个数之比为1:1,符合CnH2n-6,B的相对分子质量为78,则12n+2n-6=78,解得n=6,所以B为苯。
①A为乙烯,结构简式为:CH2=CH2。
故答案为:CH2=CH2;
②B与浓H2SO4与浓HNO3在50-60℃反应的化学反应方程为:C6H6+HNO3![]() C6H5NO2+H2O,属于取代反应。
C6H5NO2+H2O,属于取代反应。
故答案为:C6H6+HNO3![]() C6H5NO2+H2O;;取代反应。
C6H5NO2+H2O;;取代反应。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案