题目内容
根据元素性质递变规律,下列判断正确的是( )
| A、酸性:H2SiO3<H3PO4<H2SO4 | B、碱性:NaOH>KOH>CsOH | C、半径:C1->C1>Na | D、沸点:H2O>H2S>H2Se |
分析:A.非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.同一主族元素的原子,从上到下,最高价氧化物对应水化物的碱的碱性逐渐增强;
C.同周期元素从左到右,元素的原子半径逐渐减小;
D.水含有氢键,沸点最高,结合相对分子质量判断.
B.同一主族元素的原子,从上到下,最高价氧化物对应水化物的碱的碱性逐渐增强;
C.同周期元素从左到右,元素的原子半径逐渐减小;
D.水含有氢键,沸点最高,结合相对分子质量判断.
解答:解:A.非金属性S>P>Si,非金属性越强,对应的最高价氧化物的水化物的酸性越强,故A正确;
B.金属性Ce>K>Na,则对应的最高价氧化物的水化物的碱性为NaOH<KOH<CsOH,故B错误;
C.同周期元素从左到右,元素的原子半径逐渐减小,应为Na>Cl,故C错误;
D.水含有氢键,沸点最高,相对分子质量H2S<H2Se,H2Se沸点较高,故D错误.
故选A.
B.金属性Ce>K>Na,则对应的最高价氧化物的水化物的碱性为NaOH<KOH<CsOH,故B错误;
C.同周期元素从左到右,元素的原子半径逐渐减小,应为Na>Cl,故C错误;
D.水含有氢键,沸点最高,相对分子质量H2S<H2Se,H2Se沸点较高,故D错误.
故选A.
点评:本题考查非金属性的比较及元素周期律,熟悉非金属元素的性质变化规律及非金属性的比较方法即可解答,难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
根据元素性质递变规律,下列判断正确的是( )
| A、酸性:HI>HBr>HCl;碱性:NaOH>KOH>RbOH | B、沸点: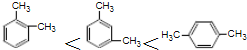 ;熔点:Na<K<Rb ;熔点:Na<K<Rb | C、可燃性:H2O<NH3<CH4;还原性:HCl<H2S<PH3 | D、还原性:Na>Mg>Al;氧化性:P>S>Cl2 |