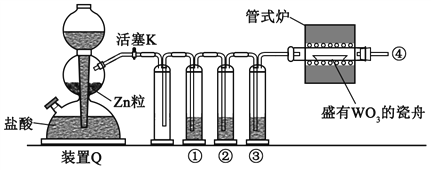
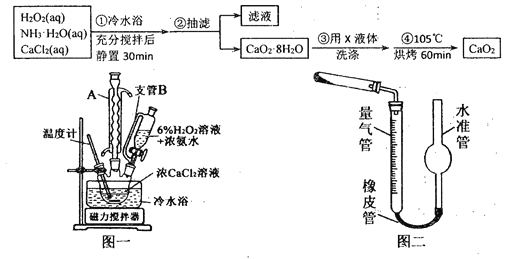
题目内容
【题目】有0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
A. 溶液①中,c(CH3COO-)=c(H+)
B. 溶液①②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-)
C. 溶液①②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D. 溶液①③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
【答案】C
【解析】
试题A、醋酸是弱电解质,在水溶液里部分电离,CH3COOH![]() CH3COO-+H+,但由于水还电离出氢离子,所以溶液①中,c(CH3COO-)<c(H+),故A不正确;B、①和②等体积混合时,二者恰好反应生成醋酸钠,其中醋酸钠的浓度是0.1mol/L÷2=0.05mol/L,而③中醋酸钠的浓度是0.1mol/L,所以混合液中c(CH3COO-)小于溶液③中的c(CH3COO- ),故B错误;C、①和②等体积混合时,二者恰好反应生成醋酸钠,根据质子守恒可知混合液中c(CH3COO-)+c(CH3COOH)=c(Na+),故C正确;D、等物质的量浓度的醋酸和醋酸钠溶液混合,醋酸电离程度大于醋酸根水解程度,导致混合溶液呈酸性,所以c(H+)>c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以得c(CH3COO-)>c(Na+),故D错误;故选C。
CH3COO-+H+,但由于水还电离出氢离子,所以溶液①中,c(CH3COO-)<c(H+),故A不正确;B、①和②等体积混合时,二者恰好反应生成醋酸钠,其中醋酸钠的浓度是0.1mol/L÷2=0.05mol/L,而③中醋酸钠的浓度是0.1mol/L,所以混合液中c(CH3COO-)小于溶液③中的c(CH3COO- ),故B错误;C、①和②等体积混合时,二者恰好反应生成醋酸钠,根据质子守恒可知混合液中c(CH3COO-)+c(CH3COOH)=c(Na+),故C正确;D、等物质的量浓度的醋酸和醋酸钠溶液混合,醋酸电离程度大于醋酸根水解程度,导致混合溶液呈酸性,所以c(H+)>c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以得c(CH3COO-)>c(Na+),故D错误;故选C。

【题目】某小组在验证反应“2Fe3+ + Cu =2Fe2+ + Cu2+”的实验中观察到溶液颜色由棕黄色变为浅绿色,且产生灰白色沉淀。发现和探究过程如下。
实验过程 | 实验现象 | |
实验1 |
| 充分振荡,棕黄色溶液逐渐变浅,最后呈浅绿色,有灰白色固体产生 |
实验1中所得溶液的颜色比预期的浅,针对其原因进行探究。
(1)甲认为:实验后,溶液中c (Cu2+)应为0.5 mol/L。“溶液颜色浅”是c (Cu2+)低于0.5 mol/L造成的。 配制含0.5 mol/L CuCl2和____________mol/L FeCl2混合溶液,观察溶液的颜色。该溶液为蓝绿色,明显比实验所得溶液颜色深,说明_________________________。
(2)甲进一步研究认为,“溶液颜色浅”与产生了灰白色固体有关。
甲查阅资料如下,猜想灰白色固体可能含有CuCl。
资料:CuCl是白色固体,不溶于水、硫酸,可溶于氨水。
为探究灰白色固体成分,设计实验方案如下:
方案1 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入过量稀硝酸,如果有白色固体剩余,则证明有CuCl |
方案2 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入浓氨水浸泡,过滤,向滤液中加入稀硫酸 |
a.按方案1进行实验2:
b.加入稀硝酸的目的是___________,反应的离子方程式是____________________________________。
c.乙认为该方案不严谨,理由是:CuCl具有还原性,被硝酸氧化后的生成物能溶于稀硝酸。
d.按方案2进行实验3:
e.加入稀硫酸时,产生的实验现象是____________,说明灰白色固体中含有CuCl。
(3)综合上述实验,说明实验1所得溶液的颜色比预期浅的原因是_____________________________。
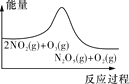
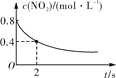
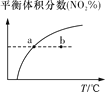
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A | B | C | D |
|
|
|
|
平衡后升温,NO2含量降低 | 0~2 s内,v(O3)=0.2 mol·L-1·s-1 | v正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
A. AB. BC. CD. D
【题目】下表各组物质中,可以实现X![]() Y
Y![]() Z(每步只发生一个反应)所示转化的是( )
Z(每步只发生一个反应)所示转化的是( )
选项 | X | Y | Z | M |
A | Fe | FeCl2 | FeCl3 | Cl2 |
B | C | CO | CO2 | O2 |
C | CO2 | Na2CO3 | NaHCO3 | NaOH |
D | AlO | Al(OH)3 | Al3+ | CO2 |
A. A B. B C. C D. D