题目内容
锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+CuSO4+2NH3•H2O═Cu4O(PO)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的电子排布式:____________;与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有____________(填元素符号)。
(2)PO43-的空间构型是____________。
(3)P、S元素第一电离能大小关系为__________________,原因为__________________。
(4)NH3·H2O分子中NH3与H2O之间氢键表示为____________。(填序号)
A.N-H…O B.O-H…N C.H-N…H D.H-O…H
(5)氨基乙酸铜分子结构如图,碳原子的杂化方式为____________,基态碳原子核外电子有____________个空间运动状态。
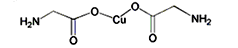
(6)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol该配合物中含有的π键的数目为______________。
(7)铜晶体为面心立方最密堆积,配位数为_______________,铜的原子半径为127.8pm,NA表示阿伏伽德罗常数的值,列出晶体铜的密度计算式______________g/cm-3
练习册系列答案
相关题目



 H2SO3,下列关于该反应的说法错误的是
H2SO3,下列关于该反应的说法错误的是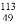 In中含有的中子数是
In中含有的中子数是
