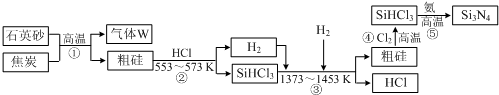
题目内容
2. 为解决能源短缺问题,工业生产中应合理利用化学能.
为解决能源短缺问题,工业生产中应合理利用化学能.(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图.
放电时甲醇应从a处通入(填“a”或“b”),电池内部H+向右(填“左”或“右”)移动.写出电池负极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
(4)已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=+226.7kJ•mol-1.
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)根据电子流向可知c为负极,负极发生氧化反应,溶液中阳离子移向正极,甲醇被氧化生成二氧化碳和水;
(3)根据反应热等于反应物的总键能-生成物的总键能求算;
(4)利用盖斯定律计算反应热,并书写热化学方程式.
解答 解:(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ,
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol;
(2)原电池中电子从负极经外电路流向正极,根据电子流向可知c电极为负极,甲醇在负极上发生氧化反应,氢离子移向正极右侧,电极反应式为CH3OH-6e-+H2O=CO2+6H+,
故答案为:a;右;CH3OH-6e-+H2O=CO2+6H+;
(3)N2(g)+3H2(g)???2NH3(g)△H=945kJ•mol-1+436kJ•mol-1×3-akJ•mol-1×6=-93kJ•mol-1,a=391 kJ•mol-1,故答案为:391;
(4)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1
利用盖斯定律将①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$可得:
2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)×2+$\frac{1}{2}$×(-571.6kJ/mol)-$\frac{1}{2}$×(-2599 kJ/mol)=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1.
点评 本题考查了热化学方程式的书写、原电池原理以及电极反应式的书写、据键能计算焓变、盖斯定律的应用,题目难度不大.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案 最多可能有多少个碳原子共面( )
最多可能有多少个碳原子共面( )| A. | 12 | B. | 11 | C. | 10 | D. | 9 |
| A. | 金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 氯气溶于水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH${\;}_{4}^{+}$+OH-═NH3↑+H2O |
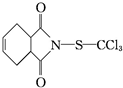 )是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )
)是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )| A. | 克菌丹的分子式为C9H8O2NSCl3,属于芳香族化合物 | |
| B. | 克菌丹易溶于水,在加热条件下不能与NaOH溶液反应 | |
| C. | 克菌丹能与溴的CCl4溶液发生取代反应使之褪色 | |
| D. | 克菌丹在一定条件下能发生取代、加聚等反应 |
| A. | 质子数与中子数相等的氢原子符号${:}_{1}^{1}$H | |
| B. | 乙烯的比例模型: | |
| C. | 双氧水的电子式:${H}_{•}^{•}{\stackrel{••}{\underset{••}{O}}}_{•}^{•}{\stackrel{••}{\underset{••}{O}}}_{•}^{•}$H | |
| D. | 次氯酸的结构式:H-O-Cl |
| A. | 该反应中次磷酸根离子得电子,表现还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 该反应每消耗3 molX,转移电子的物质的量为2mol | |
| D. | 若将硫酸铜溶液换成硝酸银溶液,容器内壁不会形成镀层 |
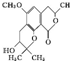
| A. | 每个分子中有2个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1 mol该物质最多可与含2 mol NaOH的水溶液反应 | |
| D. | 分子中有3种含氧官能团 |