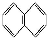
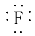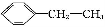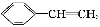题目内容
下列关于实验原理或操作的叙述,正确的是( )

A.实验室欲用480 mL 0.2 mol·L-1 H2SO4溶液,可用500 mL容量瓶配制
B.用如图所示装置测定NaOH溶液的浓度
C.铜与浓硫酸反应时,用蘸有浓溴水的棉花放在导管口吸收多余的气体
D.用pH试纸测得新制氯水的pH为4
A
【解析】因为没有480 mL的容量瓶,故A正确;NaOH溶液应该用碱式滴定管,不能用酸式滴定管,NaOH溶液会腐蚀玻璃活塞,B项错误;溴水中的溴有挥发性,与SO2气体一起挥发到空气中,C错;新制氯水具有漂白性,不能用pH试纸测其pH,D错。

(1)新的《环境空气质量标准》(GB 3095 2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
①汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因 。
②汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol
2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH= kJ/mol。
(2)直接排放氮氧化物会形成酸雨、雾霾,催化还原法和氧化吸收法是常用的处理方法。利用NH3和CH4等气体除去烟气中的氮氧化物。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=a kJ/mol;欲计算反应CH4(g)+4NO(g)=CO2(g)+2H2O(l)+2N2(g)的焓变ΔH2则还需要查询某反应的焓变ΔH3,当反应中各物质的化学计量数之比为最简整数比时,ΔH3=b kJ/mol,该反应的热化学方程式是 ,据此计算出ΔH2= kJ/mol(用含a、b的式子表示)。
(3)下表列出了工业上吸收SO2的三种方法。
方法Ⅰ | 用氨水将SO2转化(NH4)2SO3,再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
方法Ⅱ主要发生了下列反应:
2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0 kJ/mol
2H2(g)+SO2(g)=S(g)+2H2O(g)ΔH=+90.4 kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
则S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为 。
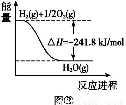
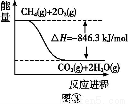
(4)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。

由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 | KHCO3 | K2SO4 | KMnO4 |
溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 。(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ;不宜用盐酸的原因是 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g 左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 。
②达到滴定终点的标志为 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为 。