��Ŀ����
����Ŀ��NH3 ��һ����Ҫ�Ļ���ԭ�ϣ���ҵ���� H2��N2�ϳɡ�
��1����ҵ���ɽ�̿����Ȼ���������Ĺ����л����һ����̼��Ϊ�˾�����ȥ�����л��е� һ����̼�����ڴ������ڵ������·�����Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g����H=��41.0kJ/mol �÷�Ӧ�ڹ�ҵ�ϱ���Ϊ��һ����̼�任����Ӧ��
CO2��g��+H2��g����H=��41.0kJ/mol �÷�Ӧ�ڹ�ҵ�ϱ���Ϊ��һ����̼�任����Ӧ��
����һ���ݻ�Ϊ 2L �ĺ����ܱ������м��� 1molCO �� 3molH2O��g��������������Ӧ��5min ��ﵽƽ�⣬��÷ų�����Ϊ 20.5kJ�����ʱ����ڷ�Ӧ��ƽ��������(CO)=______�����¶��¸÷�Ӧƽ�ⳣ�� K=_____�����¶����ڴ������м��� 3molCO �� 1molH2O��g������������Ӧ���ﵽƽ���ų��� ��_____20.5kJ(������������=����������)��
����֪��ͬ��Ӧ��Ͷ�ϱȣ�![]() ���£�ƽ���������� CO ������������±���ʾ��
���£�ƽ���������� CO ������������±���ʾ��
�¶�(��)\Ͷ�ϱ� | 1 | 3 | 5 |
200�� | 0.70 | 0.21 | 0.02 |
�ӱ������ݷ�����֪��
��Ӧ��Ͷ�ϱ�Խ��CO ��ƽ��ת����Խ________��������������С������ ���Ʋ��淴Ӧ��Ͷ�ϱ�����H2O��ƽ��ת���ʵı仯������______������ĸ����
A������ B����С C���ȼ�С������ D����������С
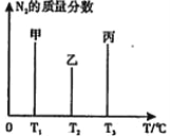
��2���� 2mol N2��3molH2�ϳɰ����������ķ�Ӧ�¶ȷֱ�Ϊ T1��T2��T3�Һ㶨���䣬�� ����������ͬ������£�ʵ���÷�Ӧ�����е�t minʱN2������������ͼ��ʾ����ʱ�ס��ҡ�������������һ���ﵽ��ѧƽ��״̬����_____�����ﵽƽ��״̬ʱ��N2ת������͵���________������������������������������գ�
��3��NH3��CO2��120�棬���������¿��Ժϳɷ�Ӧ�������أ� CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)�ں��º��ݵ��ܱ�������Ͷ�뷴Ӧ����������NH3�ĺ����仯��ϵ��ͼ��ʾ����
CO(NH2)2(s)+H2O(g)�ں��º��ݵ��ܱ�������Ͷ�뷴Ӧ����������NH3�ĺ����仯��ϵ��ͼ��ʾ����
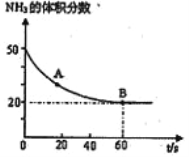
A ����淴Ӧ����V����CO2��_____B �������Ӧ���� V����CO2��(���������� ��=����������)��NH3��ƽ��ת����Ϊ____________��
��4����֪ NH2COONH4(s)![]() 2NH3(g)+CO2(g)������һ�� NH2COONH4(s)���ں��� �ܱ������У���ֽ�ﵽƽ��״̬����ʱ������ѹǿΪ P1�����������ܶ�Ϊ��1����С�� �����ݻ����ٴδ�ƽ��ʱ��������ѹǿΪP2�����������ܶ�Ϊ��2����P1____________P2�� ��1_____________________��2(������������=����������)��
2NH3(g)+CO2(g)������һ�� NH2COONH4(s)���ں��� �ܱ������У���ֽ�ﵽƽ��״̬����ʱ������ѹǿΪ P1�����������ܶ�Ϊ��1����С�� �����ݻ����ٴδ�ƽ��ʱ��������ѹǿΪP2�����������ܶ�Ϊ��2����P1____________P2�� ��1_____________________��2(������������=����������)��
���𰸡� 0.05mol/��Lmin) 0.2 = �� B �� �� �� 75% = =
����������1���ٸ��ݷ�Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g����H=��41.0kJ/mol 5min ��ﵽƽ�⣬��÷ų�����Ϊ 20.5kJ����Ӧ����CO�����ʵ���Ϊ
CO2��g��+H2��g����H=��41.0kJ/mol 5min ��ﵽƽ�⣬��÷ų�����Ϊ 20.5kJ����Ӧ����CO�����ʵ���Ϊ![]() �����ʱ����ڷ�Ӧ��ƽ������
�����ʱ����ڷ�Ӧ��ƽ������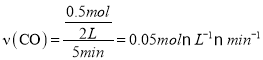 �����¶���CO��H2O��CO2��H2��ƽ��Ũ�ȷֱ�Ϊ0.25mol/L��1.25mol/L��0.25mol/L��0.25mol/L���÷�Ӧƽ�ⳣ��
�����¶���CO��H2O��CO2��H2��ƽ��Ũ�ȷֱ�Ϊ0.25mol/L��1.25mol/L��0.25mol/L��0.25mol/L���÷�Ӧƽ�ⳣ�� ![]() �����¶����ڴ������м��� 3molCO �� 1molH2O��g������������Ӧ��ǰһ��ΪCOת����50%����һ��ΪH2O��g��ת����50%���ﵽƽ���ų�����=20.5kJ���ڸ��ݱ������ݿ�֪����Ӧ��Ͷ�ϱ�Խ��CO ��ƽ��ת����Խ�� ���Ʋ��淴Ӧ��Ͷ�ϱ�����H2O��ƽ��ת���ʵı仯�����Ǽ�С����ѡB����2���÷�Ӧ�Ǵ�����Ӧ����ʼ�ģ��������ŷ�Ӧ�Ľ��У�N2��Ũ����С���京��Ҳ�ڲ��Ͻ��ͣ�����Ӧ�ﵽƽ��ʱ�ﵽ��Сֵ���˺����ŷ�Ӧ�¶ȵ����ߣ���ѧƽ�������ƶ���N2��Ũ���������京��Ҳ�ڲ������ࡣ����T3��T2ʱ�࣬˵��T3��״̬�����Ѿ��ﵽƽ��״̬�ģ�����һ���ﵽƽ��״̬��T2ʱ�Ƿ�ﵽƽ��״̬����ȷ���������߶��ﵽƽ��״̬�������¶�T1< T2<T3�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ���N2��ת���ʽ��͡������ڶ��ﵽƽ��״̬ʱ��N2ת������͵��DZ�����3����ӦCO2(g)+2NH3(g)
�����¶����ڴ������м��� 3molCO �� 1molH2O��g������������Ӧ��ǰһ��ΪCOת����50%����һ��ΪH2O��g��ת����50%���ﵽƽ���ų�����=20.5kJ���ڸ��ݱ������ݿ�֪����Ӧ��Ͷ�ϱ�Խ��CO ��ƽ��ת����Խ�� ���Ʋ��淴Ӧ��Ͷ�ϱ�����H2O��ƽ��ת���ʵı仯�����Ǽ�С����ѡB����2���÷�Ӧ�Ǵ�����Ӧ����ʼ�ģ��������ŷ�Ӧ�Ľ��У�N2��Ũ����С���京��Ҳ�ڲ��Ͻ��ͣ�����Ӧ�ﵽƽ��ʱ�ﵽ��Сֵ���˺����ŷ�Ӧ�¶ȵ����ߣ���ѧƽ�������ƶ���N2��Ũ���������京��Ҳ�ڲ������ࡣ����T3��T2ʱ�࣬˵��T3��״̬�����Ѿ��ﵽƽ��״̬�ģ�����һ���ﵽƽ��״̬��T2ʱ�Ƿ�ﵽƽ��״̬����ȷ���������߶��ﵽƽ��״̬�������¶�T1< T2<T3�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ���N2��ת���ʽ��͡������ڶ��ﵽƽ��״̬ʱ��N2ת������͵��DZ�����3����ӦCO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)�ж�����̼�Ƿ�Ӧ�A �㷴Ӧ��������������У�û�дﵽƽ�⣬��A�������̼Ũ�ȴ���B�㣬��A ���淴Ӧ����V����CO2����B �������Ӧ���� V����CO2������ʼʱNH3���������Ϊ50%����NH3��CO2��1mol/L��ƽ��ʱNH3���������Ϊ20%����ƽ��ת����Ϊx����
CO(NH2)2(s)+H2O(g)�ж�����̼�Ƿ�Ӧ�A �㷴Ӧ��������������У�û�дﵽƽ�⣬��A�������̼Ũ�ȴ���B�㣬��A ���淴Ӧ����V����CO2����B �������Ӧ���� V����CO2������ʼʱNH3���������Ϊ50%����NH3��CO2��1mol/L��ƽ��ʱNH3���������Ϊ20%����ƽ��ת����Ϊx����
CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
��ʼʱŨ��(mol/L) 1 1 0
�ı��Ũ��(mol/L) ![]() x
x ![]()
ƽ��ʱŨ��(mol/L) 1-![]() 1-x
1-x ![]()
![]() �����x=0.75mol/L��ת����Ϊ
�����x=0.75mol/L��ת����Ϊ![]() ��4����֪ NH2COONH4(s)
��4����֪ NH2COONH4(s)![]() 2NH3(g)+CO2(g)������һ���� NH2COONH4(s)���ں��� �ܱ������У���ֽ�ﵽƽ��״̬����ʱ������ѹǿΪ P1�����������ܶ�Ϊ��1����С�� �����ݻ����ٴδ�ƽ��ʱ��������ѹǿΪP2�����������ܶ�Ϊ��2����С����൱������ѹǿ����NH2COONH4�ǹ��壬ѹǿ�������죬����ѹP1=P2��ѹǿ���䣬����������䣬��ӦΪ��Чƽ�⣬ ��1=��2��
2NH3(g)+CO2(g)������һ���� NH2COONH4(s)���ں��� �ܱ������У���ֽ�ﵽƽ��״̬����ʱ������ѹǿΪ P1�����������ܶ�Ϊ��1����С�� �����ݻ����ٴδ�ƽ��ʱ��������ѹǿΪP2�����������ܶ�Ϊ��2����С����൱������ѹǿ����NH2COONH4�ǹ��壬ѹǿ�������죬����ѹP1=P2��ѹǿ���䣬����������䣬��ӦΪ��Чƽ�⣬ ��1=��2��

 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�