题目内容
已知有:
(l) =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·
(2) =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·
(3) =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·
(4) =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·
下列关系式中正确的是 ( )
(l)
 =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·
(2)
 =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·
(3)
 =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·
(4)
 =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·
下列关系式中正确的是 ( )
| A.a<c <0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
C
试题分析:对于一式和二式,反应物和生成物状态一样,只是二式中的各物质是一式的两倍,所以2a=b,一式和二式都是燃烧反应,故b<0,三式和四式中的生成物是液态,所以三式放出的热量大于一式,故a>c,同理,b>d<0,故选C。
点评:书写和应用热化学方程式时必须注意以下几点:
(1)反应热与温度和压强等测定条件有关,所以书写时指明反应时的温度和压强(25℃、101kPa时,可以不注明)
(2)各物质化学式右侧用圆括弧()表明物质的聚集状态。可以用g、l、s分别代表气态、液态、固态。固体有不同晶态时,还需将晶态注明,例如S(斜方),S(单斜),C(石墨),C(金刚石)等。溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq,∝) 代表无限稀释水溶液。
(3)热化学方程式中化学计量数只表示该物质的物质的量,不表示物质分子个数或原子个数,因此,它可以是整数,也可以是分数。
(4)△H只能写在化学方程式的右边,若为放热反应,则△H为“-”;若为吸热反应,则△H为“+”。其单位一般为kJ/mol。同一化学反应,若化学计量数不同时△H的值不同。若化学计量数相同,当反应物、生成物状态不同时,△H的值也不同。
(5)热化学方程式是表示反应已完成的数量。由于△H与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
(6)不标“↑”或“↓”
(7)不注明反应条件,例如:△(加热)
(8)有机热化学方程式用“=”,不用“→”

练习册系列答案
相关题目
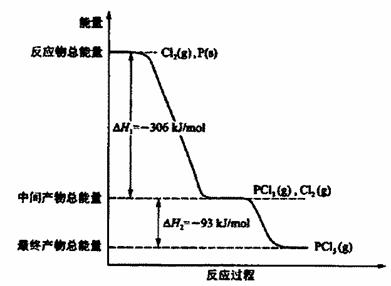
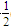 O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2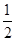 O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1
O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1