题目内容
【题目】2-aminco-3-chlorobenzoicdi acid 是重要的医药中间体,其合成路线如下:
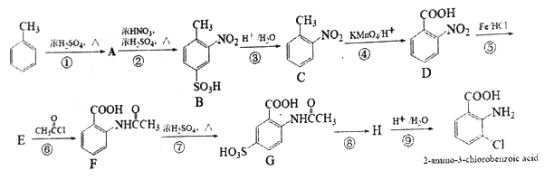
已知:①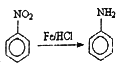 ;②酰胺键(
;②酰胺键(![]() )的性质类似于酯基。
)的性质类似于酯基。
回答下列问题:
(1)C的名称为________,2-amino-3-chlorobenzoic acid 含有的官能团名称为氯原子、_____。
(2)反应①~⑨中,不属于取代反应的有_____(填序号)。
(3)符合下列条件C 的同分异构体共有______种。
a.含有苯环 b.既能与酸反应又能与碱反应 c.不能发生水解反应
(4)不使用甲苯直接硝化的方法制备C 的原因是_____________。
(5)写出⑥的化学反应方程式:________,该步反应的主要目的是________。
(6)写出⑧的反应试剂和条件: _______。
(7)写出以![]() 为原料,制备含酰胺键(
为原料,制备含酰胺键(![]() )的聚合物的合成路线(无机试剂任用,合成路线流程图示例见本题题干)。_________________
)的聚合物的合成路线(无机试剂任用,合成路线流程图示例见本题题干)。_________________
【答案】 )邻硝基甲苯(或2-硝基甲苯) 氨基、羧基 ④⑤ 13 保证硝基能取代在甲基的邻位(或防止硝基取代在甲基的对位) 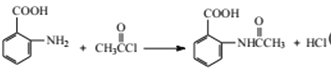 保护氨基不被后续反应氧化 Cl2,FeCl3(或Fe)
保护氨基不被后续反应氧化 Cl2,FeCl3(或Fe) 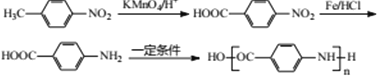
【解析】考查有机物的推断和合成,(1)根据C的结构简式,C的名称―邻硝基甲苯或2-硝基甲苯;根据2-amino-3-chlorobenzoic acid的结构简式,含有官能团是氯原子、氨基、羧基;(2)根据B的结构简式,反应①引入-SO3H,反应类型为取代反应,反应②引入-NO2,发生硝化反应,即为取代反应,B和C结构简式的对比,去掉了-SO3H,添加了一个H,反应③的类型为取代反应,反应④是酸性高锰酸钾把甲基氧化成羧基,属于氧化反应;反应⑤是-NO2→-NH2,属于还原反应,反应⑥是E中的氨基去掉一个H,CH3COCl中去掉一个Cl,反应类型为取代反应,反应⑦引入-SO3H,属于取代反应,反应⑧应发生水解反应,属于取代反应,反应⑨属于取代反应,因此不属于取代反应的是④⑤;(3)含有苯环,既能与酸反应又能与碱反应,说明含有羧基和氨基,或酚羟基、醛基、氨基,不能发生水解,说明不含有酯基或酰胺键,即同分异构体为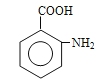 (邻间对三种)、
(邻间对三种)、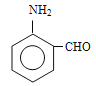 (羟基在苯环上的位置有4种)、
(羟基在苯环上的位置有4种)、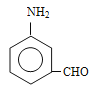 (羟基在苯环上的位置有4种)、
(羟基在苯环上的位置有4种)、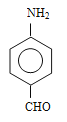 (羟基在苯环上的位置有2种),共有13种;(4)原因是保证硝基能取代在甲基的邻位(或防止硝基取代在甲基的对位);(5)根据(2)的分析,E的结构简式为
(羟基在苯环上的位置有2种),共有13种;(4)原因是保证硝基能取代在甲基的邻位(或防止硝基取代在甲基的对位);(5)根据(2)的分析,E的结构简式为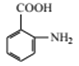 ,反应⑥为取代反应,化学反应方程式为
,反应⑥为取代反应,化学反应方程式为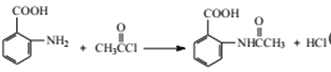 ,目的是保护氨基不被后续反应氧化;(6)反应⑧是引入-Cl,反应试剂和条件是Cl2,铁或FeCl3作催化剂;(7)因为氨基容易被氧化,因此先把甲基氧化成羧基,然后在Fe、HCl条件下,将-NO2转化成-NH2,最后发生缩聚反应,即合成路线为
,目的是保护氨基不被后续反应氧化;(6)反应⑧是引入-Cl,反应试剂和条件是Cl2,铁或FeCl3作催化剂;(7)因为氨基容易被氧化,因此先把甲基氧化成羧基,然后在Fe、HCl条件下,将-NO2转化成-NH2,最后发生缩聚反应,即合成路线为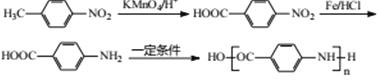 。
。

【题目】温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: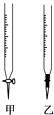
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
(1)操作F中应该选择图中 滴定管(填标号)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 .若指示剂改为甲基橙则颜色的变化是 。
(3)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | |||
① | 20 | 1.02 | 21.03 | |
② | 20 | 2.00 | 25.00 | |
③ | 20 | 0.60 | 20.59 | |
滴定中误差较大的是第 次实验,造成这种误差的可能原因是 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为mol/L。