题目内容
900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: ΔH=a kJ·mol—1。
ΔH=a kJ·mol—1。
经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
A.反应在前20 min的平均速率为v(H2)=0.008mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol·L-1,则a<0
C.保持其他条件不变,再向容器中充入0.40 mol乙苯和0.40molH2,平衡不移动
D.达平衡状态的标志是气体密度不再变化
C
解析试题分析:A.由表中的数据可知:当反应进行到20分钟时,n(乙苯)=0.24mol,消耗了乙苯(0.40-0.24)mol=0.16mol.则产生H2的物质的量为:n(H2)=" 0.16mol," v(H2)=ΔC/Δt=(0.16mol÷2.0L)÷20min =0.004mol/(L·mil).错误。B.根据表中数据可知:当反应达到平衡时,n(苯乙烯)=0.20mol,n(H2)= 0.20mol,n(乙苯)=0.20mol.C(乙苯)= n(乙苯)÷V="0.20mol÷2.0L=0.1mol/L." 在900℃时当反应达到化学平衡时K="(0.1mol/L×0.1mol/L)" ÷0.1mol/L=0.1mol/L.若保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol·L-1,说明平衡向正反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。正反应方向是吸热反应,则a>0.错误。C.在保持其他条件不变,再向容器中充入0.40 mol乙苯和0.40molH2,{C(H2)·C(苯乙烯)} ÷C(乙苯)={(0.6÷2)mol/L×0.1 mol/L}÷(0.6÷2)mol/L=0.1mol/L=K。所以平衡不发生移动。正确。D.由于该反应是在体积恒定的密闭容器中进行的,在任何时刻气体密度都不会发生变化。错误。
考点:考查外界条件对化学反应速率、化学平衡的影响的知识。

 名校课堂系列答案
名校课堂系列答案已知298 K,101 kPa时,2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
| A.Q2<Q1<197 kJ·mol-1 | B.Q2=Q1=197 kJ·mol-1 |
| C.Q1<Q2<197 kJ·mol-1 | D.Q2=Q1<197 kJ·mol-1 |
决定化学反应速率的根本因素是( )
| A.温度和压强 | B.反应物的浓度 | C.反应物的性质 | D.催化剂 |
在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则
| A.平衡向正反应方向移动了 | B.平衡向逆反应方向移动了 |
| C.物质B的质量分数减小了 | D.a>b |
在密闭容器中进行下列反应M(g)+N(g)  R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是( )
R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是( )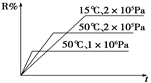
| A.正反应放热,L为气体 |
| B.正反应吸热,L为固体或纯液体 |
| C.正反应吸热,L为气体 |
| D.正反应放热,L为固体或纯液体 |
可逆反应① 、②
、②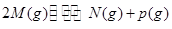 分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
下列判断正确的是:
| A.反应①的正反应是吸热反应 |
| B.在平衡(I)和平衡(II)中的气体摩尔体积相同 |
| C.达平衡(I)时X的体积分数为5/11 |
| D.达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11 |
可逆反应N2+3H2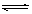 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化表示。下列各关系中能说明反应已达到平衡状态的是
| A.3υ正 (N2)=υ正 (H2) | B.υ正 (N2)=υ逆 (NH3) |
| C.2υ正 (H2)=3υ逆 (NH3) | D.υ正 (N2)=3υ逆 (H2) |
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是( )
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是( )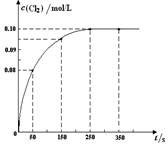
| A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s) |
| B.该温度下,反应的平衡常数K = 0.025(不考虑单位) |
| C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0 |
| D.反应达平衡后,再向容器中充入 1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L |
 xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是( )
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是( )