题目内容
在过量的稀硫酸溶液中加入5.6g Fe粉,待反应完全后,再加入50mL 0.5mol?L-1 KNO3溶液,恰好反应完全.该反应的方程式为:_FeSO4+_KNO3+_H2SO4=_K2SO4+_Fe(SO4)3+_NxOy+_H2O,则对该反应的下列说法正确的是( )
| A、反应中还原产物是NO |
| B、氧化产物和还原产物的物质的量之比为1:4 |
| C、反应过程中转移的电子数为8e- |
| D、化学方程式中按物质顺序的化学计量数是8、2、5、1、4、1、5 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:该反应中Fe元素化合价由+2价变为+3价,根据原子守恒得n(Fe)=n(FeSO4)=
=0.1mol,n(KNO3)=0.5mol/L×0.05L=0.025mol,二者的物质的量之比=0.1mol:0.025mol=4:1,根据转移电子相等得4×1=1×(5-y),y=+1,根据O原子守恒得x=2,该反应方程式为8FeSO4+2KNO3+5H2SO4=1K2SO4+4Fe(SO4)3+1N2O+5H2O,再结合题目分析解答.
| 5.6g |
| 56g/mol |
解答:
解:该反应中Fe元素化合价由+2价变为+3价,根据原子守恒得n(Fe)=n(FeSO4)=
=0.1mol,n(KNO3)=0.5mol/L×0.05L=0.025mol,二者的物质的量之比=0.1mol:0.025mol=4:1,根据转移电子相等得4×1=1×(5-y),y=+1,根据O原子守恒得x=2,该反应方程式为8FeSO4+2KNO3+5H2SO4=K2SO4+4Fe(SO4)3+N2O+5H2O,
A.该反应中还原产物是N2O,故A错误;
B.氧化产物和还原产物的物质的量之比为4:1,故B错误;
C.反应过程中转移的电子数为8e-,故C正确;
D.通过以上分析知,化学方程式中按物质顺序的化学计量数是8、2、5、1、4、1、5,故D正确;
故选CD.
| 5.6g |
| 56g/mol |
A.该反应中还原产物是N2O,故A错误;
B.氧化产物和还原产物的物质的量之比为4:1,故B错误;
C.反应过程中转移的电子数为8e-,故C正确;
D.通过以上分析知,化学方程式中按物质顺序的化学计量数是8、2、5、1、4、1、5,故D正确;
故选CD.
点评:本题考查了氧化还原反应,根据转移电子相等及原子守恒配平方程式,正确判断y值是解本题关键,题目难度中等.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
下列说法不正确的是( )
| A、盛有被KCl饱和溶液浸泡过的琼脂的U型管,可用作原电池的盐桥 |
| B、Al3+能水解为Al(OH)3胶体,明矾可用作净水剂 |
| C、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| D、甲醛能使蛋白质变性,可用作食品防腐剂 |
一定量的镁铝合金与500mL 1mol?L-1 HNO3完全反应生成2.24LNO(标况),再向反应后的溶液中加入2mol?L-1 NaOH溶液,使镁、铝元素完全沉淀,则所加NaOH溶液体积是( )
| A、50mL | B、100mL |
| C、150mL | D、200mL |
下列有关化学用语表示正确的是( )
A、Be原子的结构示意图: | ||
B、乙酸的结构简式: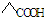 | ||
C、中子数为16的硫原子:
| ||
D、NH4Cl的电子式: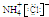 |
利用如图装置可实现在铜片上镀镍,下列有关说法不正确的是( )


| A、a为正极,d极为铜片 |
| B、甲池是燃料电池、乙池是电镀池 |
| C、b极上发生的电极反应为:CH4+10OH--8e-═CO32-+7H2O |
| D、c极上发生的电极反应为:Ni2++2e-═Ni |
以下对粒子结构或性质的叙述正确的是( )
| A、两种微粒,若核外电子排布完全相同,则化学性质一定相同 |
| B、由单原子形成的离子,一定具有稀有气体元素原子核外电子排布 |
| C、阴离子的核外电子排布一定与上一周期稀有气体原子核外排布相同 |
| D、两原子,如果核外电子排布相同,则一定属于同一种元素 |
能用H++OH-=H2O来表示的化学反应是( )
| A、Cu(OH)2和H2SO4溶液反应 |
| B、KOH溶液和醋酸溶液反应 |
| C、澄清石灰水和HNO3溶液反应 |
| D、Ba(OH)2溶液和H2SO4溶液反应 |