题目内容
元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩.
(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。 与铜相比,其金属活泼性 (填“强”或“弱”);
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是 ;
⑶工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放人电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知KsP[ Fe(OH)3]=4.0×10-38,KsP[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为金属单质。
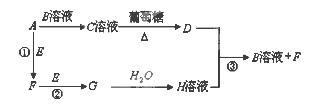
请回答下列问题:
(1)A的电子式为 D的化学式 ,C溶液的名称是 。
(2)反应①的化学方程式为 ;
反应③的离子方程式为 。
Ⅰ.铬化学丰富多彩.
(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。 与铜相比,其金属活泼性 (填“强”或“弱”);
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是 ;
⑶工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放人电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知KsP[ Fe(OH)3]=4.0×10-38,KsP[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为金属单质。

请回答下列问题:
(1)A的电子式为 D的化学式 ,C溶液的名称是 。
(2)反应①的化学方程式为 ;
反应③的离子方程式为 。
Ⅰ(1)强(1分) (2)Cr(OH)3 H++CrO2-+H2O (2分)
H++CrO2-+H2O (2分)
(3)3.0×10-6mol?L?1
Ⅱ(1) ;Ag(1分);银氨溶液(2分)
;Ag(1分);银氨溶液(2分)
(2)4NH3+5O2 4NO+5H2O (2分);3Ag+4H++NO3?=3Ag++2H2O+NO↑(2分)
4NO+5H2O (2分);3Ag+4H++NO3?=3Ag++2H2O+NO↑(2分)
 H++CrO2-+H2O (2分)
H++CrO2-+H2O (2分)(3)3.0×10-6mol?L?1
Ⅱ(1)
 ;Ag(1分);银氨溶液(2分)
;Ag(1分);银氨溶液(2分)(2)4NH3+5O2
 4NO+5H2O (2分);3Ag+4H++NO3?=3Ag++2H2O+NO↑(2分)
4NO+5H2O (2分);3Ag+4H++NO3?=3Ag++2H2O+NO↑(2分)试题分析:Ⅰ(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液,说明铬的活泼性大于氢,所以铬的活泼性强于铜。
(2)酸式电离生成H+,所以电离方程式为:Cr(OH)3
 H++CrO2-+H2O
H++CrO2-+H2O(3)[c(OH?)]3= KsP[ Fe(OH)3]÷c(Fe3+)=4.0×10-38÷2.0×10-13=2.0×10-25,c(Cr3+)= KsP[Cr(OH)3]÷[c(OH?)]3=6.0×l0-31÷2.0×10-25 =3.0×10-6mol?L?1
Ⅱ(1)C溶液与葡萄糖反应生成金属D,则C溶液为银氨溶液,D为Ag,根据框图可知:A为NH3,B为AgNO3,E为O2,F为NO,G为NO2,H为HNO3。NH3的电子式为:

(2)反应①为氨的催化氧化,化学方程式为:4NH3+5O2
 4NO+5H2O;反应③为Ag与稀硝酸的反应,离子方程式为:3Ag+4H++NO3?=3Ag++2H2O+NO↑。sP的计算、物质的推断。
4NO+5H2O;反应③为Ag与稀硝酸的反应,离子方程式为:3Ag+4H++NO3?=3Ag++2H2O+NO↑。sP的计算、物质的推断。 
练习册系列答案
相关题目



 )的说法正确的是
)的说法正确的是