题目内容
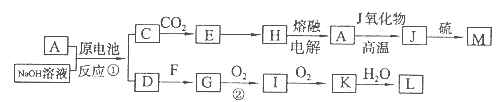
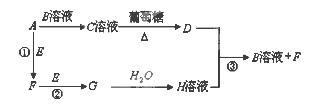
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物。B为常见液态化合物,A为淡黄色固体,将G的饱和溶液滴入沸水中,煮沸可得到红褐色胶体。请回答下列问题:

(1)A的电子式为 ,乙的组成元素在周期表中的位置是
(2)反应①~⑤中,属于非氧化还原反应的是 (填序号);C中含有的化学键有 (填序号:a离子键; b极性键 ;c 非极性键)
(3)反应⑤的化学方程式为 ;甲与B反应的离子方程式为 。
(4)F溶液中阳离子的检验方法为
(5)在F溶液中加入与F等物质的量的A恰好使F转化为E,写出该反应的离子方程式 。

(1)A的电子式为 ,乙的组成元素在周期表中的位置是
(2)反应①~⑤中,属于非氧化还原反应的是 (填序号);C中含有的化学键有 (填序号:a离子键; b极性键 ;c 非极性键)
(3)反应⑤的化学方程式为 ;甲与B反应的离子方程式为 。
(4)F溶液中阳离子的检验方法为
(5)在F溶液中加入与F等物质的量的A恰好使F转化为E,写出该反应的离子方程式 。
(1)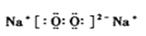 (2分);第二周期,第ⅥA族(1分)
(2分);第二周期,第ⅥA族(1分)
(2)③④(1分,缺一项不得分);a b(1分,缺一项不得分)
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分);2Na+2H2O=2Na++2OH- +H2↑(2分)
(4)取少量F溶液,滴加少量KSCN溶液,溶液无变化,再滴加双氧水或氯水,若溶液变成红色,则溶液中含有Fe2+(其它合理答案也给分)(2分)
(5)4 N a2O2+ 4Fe2+=4Fe(OH)3↓+O2↑+8Na+(2分)
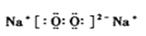 (2分);第二周期,第ⅥA族(1分)
(2分);第二周期,第ⅥA族(1分)(2)③④(1分,缺一项不得分);a b(1分,缺一项不得分)
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分);2Na+2H2O=2Na++2OH- +H2↑(2分)
(4)取少量F溶液,滴加少量KSCN溶液,溶液无变化,再滴加双氧水或氯水,若溶液变成红色,则溶液中含有Fe2+(其它合理答案也给分)(2分)
(5)4 N a2O2+ 4Fe2+=4Fe(OH)3↓+O2↑+8Na+(2分)
试题分析:B为常见液态化合物,应为水,甲、乙单质生成A为淡黄色固体,可知A为Na2O2,结合反应②产物生成乙,可知C是NaOH,乙是氧气,则甲为钠;将G的饱和溶液滴入沸水中,煮沸可得到红褐色胶体,则G是FeCl3;依次推出,E是Fe(OH)3,D是Fe(OH)2,F含二价铁。依次来解答。

练习册系列答案
相关题目