题目内容
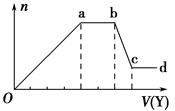
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )


| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: HZ<HY< HX |
| B.在HZ中加入NaOH至恰好完全反应时,溶液中各离子浓度大小顺序: c(Na+)>c(Z-)>c(OH—)>c(H+) |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)+c(Y—)+c(OH—)= c(Na+)+c(H+) |
| D.将HX和HZ溶液混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Na+)= c(X—)+ c(Z—) |
C
试题分析:A.三种酸的浓度相等,而溶液的pH:HZ最小; HX最大。pH越小,c(H+)越大,溶液的酸性越强,在相同温度下,酸溶液的导电能力就越强。因此在相同温度下,同浓度的三种酸溶液的导电能力顺序: HZ> HY> HX。错误。B.c(HZ)="0.100mol/L," 在未滴定时,pH=1,c(H+)="0.1mol/L=" c(HZ)。因此HZ是强酸。在HZ中加入NaOH至恰好完全反应时,得到的是强酸强碱盐。不发生水解反应。溶液中各离子浓度大小顺序: c(Na+)=c(Z-)>c(OH—)= c(H+)。错误。C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定,由于酸性HY>HX,当滴定至HX恰好完全反应时,根据电荷守恒可得:c(X—)+c(Y—)+c(OH—)= c(Na+)+c(H+)。正确。D.将HX和HZ溶液混合后,由于酸性HZ>HX用NaOH溶液滴定至HX恰好完全反应时:2c(Na+)= c(X—)+ c(Z—).错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
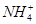 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、 、
、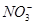 、
、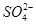 ,已知:
,已知: