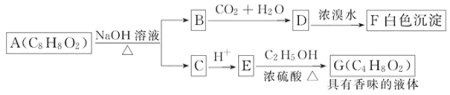
题目内容
【题目】用18mol·L-1的浓硫酸配制100mL3.0mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解
④检漏、转移、洗涤⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是__(保留一位小数),量取浓硫酸所用的量筒的规格是__(用下列编号填空)。
A.10mL B.25mL C.50mL D.100mL
(2)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”或“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水__。
②转移完溶液的烧杯、玻璃棒未洗涤__。
③加水超过刻度线后,用胶头滴管吸出多余的液体__。
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制2000mL2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为__mol·L-1。
②需用浓硫酸的体积为__mL。
【答案】16.7mL B 无影响 偏小 偏小 4.6 250
【解析】
(1)根据溶液稀释前后溶质物质的量不变计算所需浓硫酸的体积,再根据所需浓硫酸体积选择量筒规格。
(2)分析操作对溶质的物质的量或对溶液的体积的影响,根据公式![]() ,分析判断。
,分析判断。
(3)根据公式![]() ,计算浓硫酸的浓度,再根据溶液稀释前后溶质物质的量不变计算所需浓硫酸的体积。
,计算浓硫酸的浓度,再根据溶液稀释前后溶质物质的量不变计算所需浓硫酸的体积。
(1)配制100mL3.0mol/L的稀H2SO4,根据稀释定律,稀释前后溶质的物质的量不变,则根据公式![]() 可计算,
可计算,![]() ,
,![]() ,所以应量取的浓硫酸体积是16.7mL,量取浓硫酸所用的量筒的规格是25mL,故答案为:16.7mL;B。
,所以应量取的浓硫酸体积是16.7mL,量取浓硫酸所用的量筒的规格是25mL,故答案为:16.7mL;B。
(2)①容量瓶用蒸馏水洗涤后残留有少量的水,最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响,故答案为:无影响;
②所用过的烧杯、玻璃棒未洗涤,溶液中溶质未全部转移到容量瓶,所配溶液浓度偏小,故答案为:偏小;
③加水超过刻度线后,用胶头滴管吸出多余的液体,溶液被稀释,浓度偏小,故答案为:偏小;
(3)①所配制的稀硫酸为2000mL 2.3mol/L,该溶液中H+的物质的量浓度为:![]() ,故答案为:4.6。
,故答案为:4.6。
②98%,密度为1.84g·cm-3的浓硫酸的物质的量浓度为:![]() ,根据稀释定律,稀释前后溶质的物质的量不变,则根据公式
,根据稀释定律,稀释前后溶质的物质的量不变,则根据公式![]() ,
,![]() ,解得:
,解得:![]() ,所以所需浓硫酸体积为250mL,故答案为:250。
,所以所需浓硫酸体积为250mL,故答案为:250。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___和____。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为________。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
醋酸溶液浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是_________
(2)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度________(填“增大”“减小”或“不变”)。