题目内容
【题目】一份溶液中可能大量含有K+、A13+、H+、NH4+、Cl-、Br-、I-、ClO-、A1O2-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示:
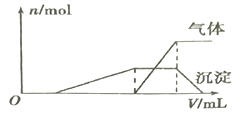
则该溶液中一定存在的离子是________,一定不大量存在的离子是__________。
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-、与通入氯气的体积(标准状况下)关系如下表所示,回答下列问题:
Cl2的体积(标准状况下) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | a mol | 0 | 0 |
当通入的氯气为2.8L(标准状况下)时,溶液中发生反应的离子方程式为___________,原溶液中n(Cl-)为____mol;通入氯气的体积在2.8L~5.6L(标准状况下)之间时的有关离子方程式为(如有多个反应,请分开书写)_________________,原溶液中Cl-、Br-、I-的物质的量浓度之比为_______________。
【答案】 Al3+、H+、NH4+ ClO-、AlO2- Cl2+2I-=2Cl-+I2 1 Cl2+2I-=2Cl-+I2、Cl2+2Br-=2Cl-+Br2 10:15:4
【解析】(1)加入NaOH,开始无气体和沉淀,则原溶液中含有H+,从而不含ClO-和AlO2-;再加入NaOH,开始产生沉淀,则原溶液中含有Al3+,当沉淀的量达到最大值时,沉淀的量不变,而开始产生气体,则原溶液中含有NH4+,当NH4+反应完后,再加NaOH溶液,沉淀溶解。据此判断:该溶液中一定存在的离子是:Al3+、H+、NH4+,一定不大量存在的离子是:ClO-、AlO2-,可能存在的离子是:K+、Cl-、Br-、I-。
(2)在含有 Cl-、Br-、I-的混合溶液中,由于还原性大小顺序为:I->Br-,通入Cl2时,Cl2先与I-反应,再与Br-反应。2.8L Cl2的物质的量为0.125mol,当第一次通入0.125molCl2时,仍有a mol I-剩余,此阶段Br-未参与反应,故原溶液中Br-的物质的量为1.5mol,所以第一次通入Cl2的过程中只发生Cl2与I-的反应。离子方程式为:Cl2+2I-=2Cl-+I2,消耗的I-的物质的量为2×0.125mol=0.25mol,则原溶液中的Cl-的物质的量为1.25 mol-0.125mol×2=1mol;通入氯气的体积在2.8L~5.6L(标准状况下)之间时(即0.125mol),未反应的a molI-先完全反应,然后Br-反应掉0.1mol,此过程中发生了两个反应:Cl2+2I-=2Cl-+I2、Cl2+2Br-=2Cl-+Br2;消耗掉0.1molBr-需要消耗0.05molCl2,所以a molI-消耗的Cl2的物质的量为0.125mol-0.05mol=0.075mol,故a=0.075mol×2=0.15mol,加上第一次消耗掉的0.25molI-,故原溶液中总共含有I-的物质的量为0.15mol+0.25mol=0.4mol。综上所述:原溶液中Cl-、Br-、I-的物质的量的比为:1:1.5:0.4=10:15:4,所以浓度比为10:15:4。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案