��Ŀ����
(15��)������ˮ��������Ⱦ��������Ҫ���⡣��ˮ�и�Ԫ����Cr2O72-��CrO42-��ʽ���ڣ������������������ǣ�
��1���������ʹCrO42-ת��ΪCr2O72-�� 2CrO42- + 2H+ Cr2O72- + H2O
Cr2O72- + H2O
��������pH=1��Һ��Cr2O72-Ũ��Ϊ0��1 mol?L-1��Cr2O72-Ũ����CrO42-Ũ�ȵ�10�����û�ѧƽ�ⳣ��K= ��
��2�����۸��Ķ��Դ�Լ�����۸���100������������ԭ������������Һ��ͨSO2��Cr2O72-��ԭ����Ӧ�����ӷ���ʽΪ �������ټӼCr3+��������֪������Ksp��Cr(OH)3�� =10-32,Ҫʹc(Cr3+)���͵�10-5mol?L-1����Һ��pHӦ���ߵ� ��
��3����ԭ�������õ�������Fe2+��Cr2O72-��ԭΪCr3+�����װ�����õĵ缫������̼������Ƭ��������Ƭ����ֱ����Դ�� ����
��4��Cr(OH)3Ϊ��ɫճ�Գ�����������Al(OH)3����������������ǿ����Һ��Cr(OH)3����ϡ����Ļ�ѧ����ʽΪ ����100��00mL 0��1000 mol?L-1CrCl3��Һ�μ�1��000mol?L-1NaOH��Һ, �뻭�����ɳ��������ʵ��������NaOH��Һ����Ĺ�ϵͼ: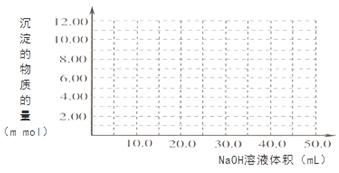
��1����1��0��105��2��3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H2O 5
��3�� ����4�� 2Cr(OH)3 + 3H2SO4 = 2Cr2(SO4)3 + 3H2O��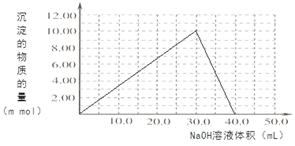 ��
��
���������������1����ѧƽ�ⳣ�� ����2����������Һ��ͨSO2��Cr2O72-��ԭΪCr3+�����ݵ����غ㼰����غ㡢ԭ���غ�ɵ÷�Ӧ�����ӷ���ʽΪ3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H2O��������Ksp��Cr(OH)3�� =10-32, c(Cr3+)=10-5mol/L,c3(OH-)=10-32��10-5=10-27������c(OH-)=10-9mol/L����c(H+)=Kw��c(OH-)=10-5mol/L,���pH=5����3����ԭ�������õ�������Fe2+��Cr2O72-��ԭΪCr3+�����װ�����õĵ缫������̼������Ƭ��������Ƭ��Ҫʧȥ���ӱ�ΪFe2+������ƬҪ���Դ���������ӡ�Cr(OH)3��ϡ���ᷴӦ��ѧ����ʽΪ2Cr(OH)3 + 3H2SO4 = 2Cr2(SO4)3 + 3H2O��n(Cr3+)=0��1L��0��100mol/L=0��01mol�������Һ�м���NaOH���ȷ�����Ӧ��Cr3����3OH-��Cr(OH)3����n(NaOH)= 0��03mol����NaOH�����Ϊ30mlʱ�����ﵽ���ֵ���ټ���NaOH��Һ��������Ӧ��Cr(OH)3+ OH-= CrO2-+ 2H2O����ʱ������NaOH�����ʵ���Ϊ0��01mol,��������10ml�����ﵽ40mlʱ��������ȫ�ܽ⡣֮���ٵμ�NaOH��Һ��Ҳ���ᷢ����Ӧ�����ɳ��������ʵ��������NaOH��Һ����Ĺ�ϵͼΪ
����2����������Һ��ͨSO2��Cr2O72-��ԭΪCr3+�����ݵ����غ㼰����غ㡢ԭ���غ�ɵ÷�Ӧ�����ӷ���ʽΪ3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H2O��������Ksp��Cr(OH)3�� =10-32, c(Cr3+)=10-5mol/L,c3(OH-)=10-32��10-5=10-27������c(OH-)=10-9mol/L����c(H+)=Kw��c(OH-)=10-5mol/L,���pH=5����3����ԭ�������õ�������Fe2+��Cr2O72-��ԭΪCr3+�����װ�����õĵ缫������̼������Ƭ��������Ƭ��Ҫʧȥ���ӱ�ΪFe2+������ƬҪ���Դ���������ӡ�Cr(OH)3��ϡ���ᷴӦ��ѧ����ʽΪ2Cr(OH)3 + 3H2SO4 = 2Cr2(SO4)3 + 3H2O��n(Cr3+)=0��1L��0��100mol/L=0��01mol�������Һ�м���NaOH���ȷ�����Ӧ��Cr3����3OH-��Cr(OH)3����n(NaOH)= 0��03mol����NaOH�����Ϊ30mlʱ�����ﵽ���ֵ���ټ���NaOH��Һ��������Ӧ��Cr(OH)3+ OH-= CrO2-+ 2H2O����ʱ������NaOH�����ʵ���Ϊ0��01mol,��������10ml�����ﵽ40mlʱ��������ȫ�ܽ⡣֮���ٵμ�NaOH��Һ��Ҳ���ᷢ����Ӧ�����ɳ��������ʵ��������NaOH��Һ����Ĺ�ϵͼΪ ��
��
���㣺���黯ѧ�����ܽ�ƽ�⡢ƽ�ⳣ���ļ��㡢��������������Ӧ�ļ����֪ʶ��

��16�֣�Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ijУ��ѧС����ʵ��ķ�������̽����
ʵ��һ������ֻ����Cu��Fe��Mg�Ͳ�ͬŨ�ȵ�����(0.5 mol��L��1��2 mol��L��1��18.4 mol��L��1)���ʵ�鷽�����о�Ӱ�췴Ӧ���ʵ����ء���ͬѧ��ʵ�鱨�����±���
| ʵ�鲽�� | ���� | ���� |
| �ٷֱ�ȡ�������2 mol��L��1���������Թ��� | ��Ӧ����Mg>Fe��Cu����Ӧ | ����������Խ���ã���Ӧ����Խ�� |
| ��____________ | | ��Ӧ��Ũ��Խ��Ӧ����Խ�� |
��2����ͬѧ��ʵ��Ŀ����_____________��Ҫ�ó���ȷ��ʵ����ۣ�������Ƶ�ʵ��������____________����ͬѧΪ�˸���ȷ���о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬������ͼ��ʾװ�ý��ж���ʵ�顣
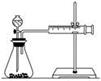
��3����ͬѧ��ʵ����Ӧ�òⶨ��������___________________________________________________��
��4����ͬѧ��ɸ�ʵ��Ӧѡ�õ�ʵ��ҩƷ��________����ʵ���в�ѡ��ijŨ�ȵ����ᣬ������___________��
ʵ�������֪ 2KMnO4��5H2C2O4��3H2SO4===K2SO4��2MnSO4��8H2O��10CO2�����ڸ������������Һ�Ͳ�����Һ��Ӧʱ�����ֿ�ʼһ��ʱ�䣬��Ӧ���ʽ�������Һ��ɫ�����ԣ�������ͻȻ��ɫ����Ӧ�������Լӿ졣
��5���������ʵ������ͬѧ��ΪKMnO4��H2C2O4��Ӧ���ȣ�������Һ�¶����ߣ���Ӧ���ʼӿ졣��Ӱ�컯ѧ��Ӧ���ʵ����ؿ�������뻹������______________��Ӱ�졣
��6������ʵ��֤����IJ��룬���������������Һ��������Һ�⣬����Ҫѡ����Լ����������________(����ĸ)��
A������ء�������������B�������� C�����Ȼ��� D��ˮ
(9��)��֪A(g)+B(g)  C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| |�¶�/ �� | 700 | 900 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)�÷�Ӧ��ƽ�ⳣ������ʽK= ����H 0���<���� >���� =��)��
(2)830��ʱ����һ��5 L���ܱ������г���0.20mol��A��0.80mol��B���練Ӧ��ʼ6s��A��ƽ����Ӧ����v(A)=0��003 mol��L-1��s-1����6sʱc(A)= mol��L-1�� C�����ʵ���Ϊ mol������Ӧ��һ��ʱ��ﵽƽ��ʱA��ת����Ϊ �������ʱ����ܱ��������ٳ���1 mol�����ƽ��ʱA��ת����Ϊ ��
(3)�жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ (����ȷѡ��ǰ����ĸ)��
a��ѹǿ����ʱ��ı� b��������ܶȲ���ʱ��ı�
c��c(A)����ʱ��ı� d����λʱ��������C��D�����ʵ������
(4)1200��ʱ��ӦC(g)+D(g)
 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ �� 
 CH3OCH3��g��+3H2O��g�� ��H=-122��4kJ��mol��1
CH3OCH3��g��+3H2O��g�� ��H=-122��4kJ��mol��1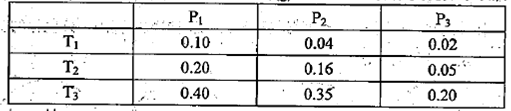
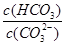 ����������䡱��С��������̼�����Һ���տ�����CO2�����ܶɳ�����ʱ�����й�ϵ��˵����ȷ���� ��
����������䡱��С��������̼�����Һ���տ�����CO2�����ܶɳ�����ʱ�����й�ϵ��˵����ȷ���� ��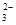 ��+c��HCO
��+c��HCO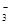 ��+c��H2CO3��
��+c��H2CO3�� c��CO
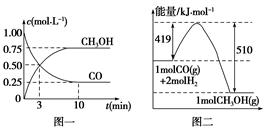
c��CO CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺
CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺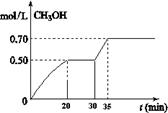
 Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣
Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣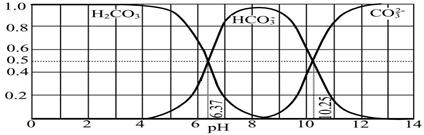
 2SO3(g�� ��H����196 kJ?mol��1����һ���̶��ݻ�Ϊ5 L���ܱ������г���0.20 mol SO2��0.10 mol O2������Ӻ�ﵽƽ�⣬��������к�SO3Ϊ0.18 mol����v(O2)���� ��mol?L��1?min��1���ų�������Ϊ�� �� kJ��
2SO3(g�� ��H����196 kJ?mol��1����һ���̶��ݻ�Ϊ5 L���ܱ������г���0.20 mol SO2��0.10 mol O2������Ӻ�ﵽƽ�⣬��������к�SO3Ϊ0.18 mol����v(O2)���� ��mol?L��1?min��1���ų�������Ϊ�� �� kJ�� 
 CH3OH(g)�������ͼʾ�ش��������⣺
CH3OH(g)�������ͼʾ�ش��������⣺