题目内容
25℃时对于pH=1的盐酸,下列叙述不正确的是
| A.c(H+)= c(Cl-)+ c(OH-) |
| B.c(H+)·c(OH-)=1.0×10—14 |
| C.由水电离出的c(H+)=1.0×10-13mol?L-1 |
| D.与pH=13的NaOH溶液混合后,混合溶液一定呈中性 |
D
解析试题分析:A、因溶液遵循电荷守恒,则c(H+)=c(Cl-)+c(OH-),故A正确;B、常温下Kw=1.0×10-14,25℃时对于pH=1的盐酸溶液中存在,c(H+)?c(OH-)=1.0×10-14,故B正确;C、常温下Kw=1.0×10-14,pH=1的盐酸溶液中由H2O电离出的c(H+)=1.0×10-13mol?L-1,故C正确;D、与pH=13的氢氧化钠溶液混合后,溶液体积不知,混合后溶液酸碱性不确定,故D错误;故选D。
考点:溶液pH的定义;酸碱混合时的定性判断及有关ph的计算

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
物质的量浓度相同的下列溶液中,NH4+浓度最大的是
| A.NH4Cl | B.NH4HCO3 | C.CH3COONH4 | D.NH4HSO4 |
下列对于溶液中的问题叙述正确的是( )
| A.向冰醋酸中加水至配成醋酸稀溶液的过程H+的浓度逐渐减小 |
| B.在稀溶液中:H+(aq) + OH-(aq) = H2O(l); △H=-57.3kJ/mol,则含1 mol HClO的稀溶液和含1 mol KOH的稀溶液完全反应放出的热量等于57.3 kJ |
| C.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 |
| D.常温下,将稀NaOH溶液与CH3COOH溶液混合,可能出现pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 |
室温下,水的电离达到平衡:H2O H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是
| A.将水加热,平衡向正反应方向移动,Kw不变 |
| B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+) |
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中
c(H+)/c(CH3COOH)值增大,可以采取的措施是 ( )
| A.加少量烧碱溶液 | B.降低温度 | C.加少量冰醋酸 | D.加水 |
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成: ① 与
与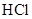 ②
②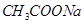 与NaOH ③
与NaOH ③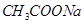 与
与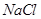 ④
④ 与
与 ,下列各项排序正确的是
,下列各项排序正确的是
| A.pH:②>③>④>① | B. :②>④>③>① :②>④>③>① |
| C.溶液中c(H+): ①>③>②>④ | D. : ①>④>③>② : ①>④>③>② |
对于0.1mol·L-1 Na2SO3溶液,正确的是( )
| A.升高温度,溶液的pH降低 |
| B.c(Na+)=2c(SO32—)+ c(HSO3—)+ c(H2SO3) |
| C.c(Na+) + c(H+) = 2c(SO32—)+ 2c(HSO3—) + c(OH—) |
| D.加入少量NaOH固体,c(SO32—)与c(Na+)均增大 |