ĢāÄæÄŚČŻ
”¾ĢāÄæ”æ»·¾³ĪŹĢāŌ½Ą“Ō½ŹÜµ½ČĖĆĒµÄÖŲŹÓ£¬ŃŠ¾æ±ķĆ÷µŖŃõ»ÆĪļŗĶ¶žŃõ»ÆĮņŌŚŠĪ³ÉĪķö²Ź±Óė“óĘųÖŠµÄ°±ÓŠ¹Ų£ØČēĶ¼ĖłŹ¾£©”£

»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©![]() µÄµē×ÓŹ½ĪŖ____________£¬
µÄµē×ÓŹ½ĪŖ____________£¬![]() ÖŠŗ¬ÓŠµÄ»Æѧ¼üŹĒ____________”£
ÖŠŗ¬ÓŠµÄ»Æѧ¼üŹĒ____________”£
£Ø2£©ĻĀĮŠ¹ŲÓŚĪķö²µÄŠšŹö“ķĪóµÄŹĒ______£ØĢīŠņŗÅ£©£ŗ
A£®Īķö²ÖŠŗ¬ÓŠĻõĖįļ§ŗĶĮņĖįļ§ B£®![]() ŹĒŠĪ³ÉĪŽ»śæÅĮ£ĪļµÄ“߻ƼĮ
ŹĒŠĪ³ÉĪŽ»śæÅĮ£ĪļµÄ“߻ƼĮ
C£®Īķö²µÄŠĪ³ÉÓė¹ż¶ČŹ©ÓƵŖ·ŹÓŠ¹Ų D£®Īķö²µÄŠĪ³É¹ż³ĢÉę¼°Ńõ»Æ»¹Ō·“Ó¦
£Ø3£©Ō¤·Ąŗ¬Įņ»ÆŗĻĪļĪķö²Éś³ÉµÄ·½·ØÖ®Ņ»ŹĒ½«°±ĘųŗĶ¶žŃõ»ÆĮņĶØČėĖ®ÖŠ£¬ŌŁ³äČė![]() ³ä·Ö·“Ӧɜ³ÉŅ»ÖÖÕżŃĪ£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________”£
³ä·Ö·“Ӧɜ³ÉŅ»ÖÖÕżŃĪ£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________”£
£Ø4£©ŌŚÓŠŃõĢõ¼žĻĀ£¬“߻ƼĮÄÜ“ß»Æ![]() Óė
Óė![]() ·“Ӧɜ³É
·“Ӧɜ³É![]() ”£½«Ņ»¶Ø±ČĄżµÄ
”£½«Ņ»¶Ø±ČĄżµÄ![]() ”¢
”¢![]() ŗĶ
ŗĶ![]() »ģŗĻĘųĢåŌČĖŁĶØČė×°ÓŠ“߻ƼĮµÄ·“Ó¦Ę÷ÖŠ·“Ó¦£¬²āµĆ·“Ó¦ĪĀ¶ČøßÓŚ380”ꏱ£¬
»ģŗĻĘųĢåŌČĖŁĶØČė×°ÓŠ“߻ƼĮµÄ·“Ó¦Ę÷ÖŠ·“Ó¦£¬²āµĆ·“Ó¦ĪĀ¶ČøßÓŚ380”ꏱ£¬![]() µÄČ„³żĀŹŃøĖŁĻĀ½µ£¬ĘäŌŅņÖ®Ņ»ŹĒ“߻ƼĮ»īŠŌĻĀ½µ£¬ĮķŅ»ÖŲŅŖŌŅņŹĒ____________”£ŌŚĪŽŃõĢõ¼žĻĀ£¬·“Ó¦Ę÷ÖŠ
µÄČ„³żĀŹŃøĖŁĻĀ½µ£¬ĘäŌŅņÖ®Ņ»ŹĒ“߻ƼĮ»īŠŌĻĀ½µ£¬ĮķŅ»ÖŲŅŖŌŅņŹĒ____________”£ŌŚĪŽŃõĢõ¼žĻĀ£¬·“Ó¦Ę÷ÖŠ![]() Äܽ«
Äܽ«![]() »¹ŌĪŖ
»¹ŌĪŖ![]() £¬µ±Éś³É
£¬µ±Éś³É![]() Ź±×ŖŅʵē×Ó______
Ź±×ŖŅʵē×Ó______![]() £ØæÉÓĆ·ÖŹż±ķŹ¾£©”£
£ØæÉÓĆ·ÖŹż±ķŹ¾£©”£
”¾“š°ø”æ![]() ¹²¼Ū¼üŗĶĄė×Ó¼ü B
¹²¼Ū¼üŗĶĄė×Ó¼ü B ![]()
![]() Óė
Óė![]() ·“Ӧɜ³ÉĮĖ
·“Ӧɜ³ÉĮĖ![]()
![]()
”¾½āĪö”æ
£Ø1£©NH3·Ö×ÓÖŠµÄNŗĶ3øöH·Ö±šŠĪ³É¹²¼Ū¼ü£¬Ź¹Ö®“ļµ½8µē×ÓŗĶ2µē×ÓĪČ¶Ø½į¹¹£¬N”¢H£¬N”¢OÖ®¼äŹĒ¹²¼Ū¼ü¶ųNH4+ŗĶNO3-Ö®¼äŹĒĄė×Ó¼ü£»
£Ø2£©ŅĄ¾Ż×Ŗ»ÆĶ¼£¬æÉ·ÖĪöĪķö²µÄ×é³É£¬¼°×Ŗ»Æ¹ż³ĢÖŠĖł·¢ÉśµÄ·“Ó¦ĄąŠĶ£»
£Ø3£©½«°±ĘųŗĶ¶žŃõ»ÆĮņĶØČėĖ®ÖŠ£¬ŌŁ³äČėŃõĘų³ä·Ö·“Ӧɜ³ÉĮņĖįļ§£»
£Ø4£©NH3¾ßÓŠ»¹ŌŠŌ£¬O2¾ßÓŠŃõ»ÆŠŌ£¬ĪĀ¶ČøßÓŚ380”ꏱ£¬NH3ŗĶO2·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬Éś³ÉNO£¬ĒŅĻūŗÄĮĖO2£¬ĖłŅŌµ¼ÖĀNOxµÄČ„³żĀŹŃøĖŁĻĀ½µ£¬ŌŚĪŽŃõĢõ¼žĻĀ£¬NH3ŗĶNO2·“ÉśŃõ»Æ»··“Ó¦£ŗ8NH3![]() 6NO2
6NO2![]() 7N2
7N2![]() 12H2O£¬ŅŌ“Ė½ā“š£»
12H2O£¬ŅŌ“Ė½ā“š£»
£Ø1£©NH3·Ö×ÓÖŠµÄNŗĶ3øöH·Ö±šŠĪ³É¹²¼Ū¼ü£¬Ęäµē×ÓŹ½ĪŖ£ŗ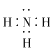 £¬NH4NO3ŹĒĄė×Ó»ÆŗĻĪļ£¬NH4+ŗĶNO3-Ö®¼äŹĒĄė×Ó¼ü£¬NH4+ŗĶNO3-ÖŠŗ¬ÓŠ¹²¼Ū¼ü£¬¹ŹNH4NO3¼ČÓŠĄė×Ó¼üÓÖÓŠ¹²¼Ū¼ü£»
£¬NH4NO3ŹĒĄė×Ó»ÆŗĻĪļ£¬NH4+ŗĶNO3-Ö®¼äŹĒĄė×Ó¼ü£¬NH4+ŗĶNO3-ÖŠŗ¬ÓŠ¹²¼Ū¼ü£¬¹ŹNH4NO3¼ČÓŠĄė×Ó¼üÓÖÓŠ¹²¼Ū¼ü£»
±¾Ģā“š°øĪŖ£ŗ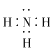 £¬¹²¼Ū¼üŗĶĄė×Ó¼ü”£
£¬¹²¼Ū¼üŗĶĄė×Ó¼ü”£
£Ø2£©A.ÓÉÓŚµŖµÄŃõ»ÆĪļ”¢¶žŃõ»ÆĮņ×Ŗ»ÆĪŖļ§ŃĪ£¬ŠĪ³ÉĪŽ»śæÅĮ£Īļ£¬ÓÉ“ĖæÉÖŖĪķö²ÖŠŗ¬ÓŠĻõĖįļ§ŗĶĮņĖįļ§£¬¹ŹAÕżČ·£»
B.“߻ƼĮŹĒÖøÄÜøıä»Æѧ·“Ó¦ĖŁĀŹ£¬¶ų±¾ÉķŌŚ»Æѧ·“Ó¦Ē°ŗóÖŹĮæŗĶ»ÆѧŠŌÖŹ¶¼²»·¢ÉśøıäµÄĪļÖŹ”£¶ųNH3²Ī¼ÓĮĖ·“Ó¦×Ŗ»Æ³ÉĮĖļ§ŃĪ£¬ĖłŅŌNH3²»ŹĒŠĪ³ÉĪŽ»śæÅĮ£µÄ“߻ƼĮ£¬¹ŹB“ķĪó£»
C. ÓÉÓŚµŖµÄŃõ»ÆĪļ”¢¶žŃõ»ÆĮņ×Ŗ»ÆĪŖļ§ŃĪ£¬ŌŚ“Ė¹ż³ĢÖŠÓė“óĘųÖŠµÄNH3ÓŠ¹Ų£¬ÓÉÓŚµŖ·Ź»įŹĶ·Å°±Ęų£¬ĖłŅŌĪķö²µÄŠĪ³ÉÓė¹ż¶ČŹ©ÓƵŖ·ŹÓŠ¹Ų£¬¹ŹCÕżČ·£»
D.Īķö²µÄŠĪ³É¹ż³ĢÖŠ£¬ÓÉNOx![]() NO5£¬SO2
NO5£¬SO2![]() SO3¾łŹōÓŚŃõ»Æ»¹Ō·“Ó¦£¬¹ŹDÕżČ·£»
SO3¾łŹōÓŚŃõ»Æ»¹Ō·“Ó¦£¬¹ŹDÕżČ·£»
±¾Ģā“š°øĪŖ£ŗB”£
£Ø3£©½«°±ĘųŗĶ¶žŃõ»ÆĮņĶØČėĖ®ÖŠ£¬ŌŁ³äČėO2³ä·Ö·“Ӧɜ³ÉĮņĖįļ§£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ4NH3![]() 2SO2
2SO2![]() O2
O2![]() 2H2O=2£ØNH4£©2SO4£»
2H2O=2£ØNH4£©2SO4£»
±¾Ģā“š°øĪŖ£ŗ4NH3![]() 2SO2
2SO2![]() O2
O2![]() 2H2O=2£ØNH4£©2SO4”£
2H2O=2£ØNH4£©2SO4”£
£Ø4£©NH3¾ßÓŠ»¹ŌŠŌ£¬O2¾ßÓŠŃõ»ÆŠŌ£¬ĪĀ¶ČøßÓŚ380”ꏱ£¬NH3ŗĶO2·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬4NH3![]() 5O2
5O2![]() 4NO
4NO![]() 6H2O£¬Éś³ÉNO£¬ĒŅĻūŗÄĮĖO2£¬ĖłŅŌµ¼ÖĀNOxµÄČ„³żĀŹŃøĖŁĻĀ½µ£»ŌŚĪŽŃõĢõ¼žĻĀ£¬NH3ŗĶNO2·“ÉśŃõ»Æ»··“Ó¦£ŗ8NH3
6H2O£¬Éś³ÉNO£¬ĒŅĻūŗÄĮĖO2£¬ĖłŅŌµ¼ÖĀNOxµÄČ„³żĀŹŃøĖŁĻĀ½µ£»ŌŚĪŽŃõĢõ¼žĻĀ£¬NH3ŗĶNO2·“ÉśŃõ»Æ»··“Ó¦£ŗ8NH3![]() 6NO2
6NO2![]() 7N2
7N2![]() 12H2O£¬øĆ·“Ó¦ÖŠNH3ÖŠµÄN»ÆŗĻ¼Ū-3
12H2O£¬øĆ·“Ó¦ÖŠNH3ÖŠµÄN»ÆŗĻ¼Ū-3![]() 0£¬NO2ÖŠNµÄ»ÆŗĻ¼Ū+4
0£¬NO2ÖŠNµÄ»ÆŗĻ¼Ū+4![]() 0£¬Éś³É7molN2×ŖŅĘ24molµē×Ó,ĖłŅŌÉś³É1molN2×ŖŅʵē×Ó24/7mol£»
0£¬Éś³É7molN2×ŖŅĘ24molµē×Ó,ĖłŅŌÉś³É1molN2×ŖŅʵē×Ó24/7mol£»
±¾Ģā“š°øĪŖ£ŗNH3ŗĶO2Éś³ÉĮĖNO£¬24/7”£

 ½Ģ²ÄČ«½ā×Ö“Ź¾äĘŖĻµĮŠ“š°ø
½Ģ²ÄČ«½ā×Ö“Ź¾äĘŖĻµĮŠ“š°ø”¾ĢāÄæ”æĻĀĮŠĪļÖŹ·ÖĄąµÄÕżČ·×éŗĻŹĒ
Ń”Ļī | »ģŗĻĪļ | »ÆŗĻĪļ | µ„ÖŹ | ŃĪ |
A | ŃĪĖį | NaOH¹ĢĢå | ŹÆÄ« | Ź³ŃĪ |
B | ¼īŹÆ»Ņ | ½šøÕŹÆ | O3 | “æ¼ī(Na2CO3) |
C | æÕĘų | ³ĪĒåŹÆ»ŅĖ® | Ģś | ŹÆ»ŅŹÆ |
D | CuSO4”¤5H2O | CaCl2 | Ė®Ņų | CaO |
A. AB. BC. CD. D
”¾ĢāÄæ”æĻĀĶ¼ĖłŹ¾µÄµē½ā³ŲIŗĶIIÖŠ£¬a”¢b”¢cŗĶd¾łĪŖPtµē¼«”£µē½ā¹ż³ĢÖŠ£¬µē¼«bŗĶdÉĻƻӊĘųĢåŅŻ³ö£¬µ«ÖŹĮæ¾łŌö“ó£¬ĒŅŌöÖŲb>d”£·ūŗĻÉĻŹöŹµŃé½į¹ūµÄŃĪČÜŅŗŹĒ

Ń”Ļī | X | Y |
A£® | MgSO4 | CuSO4 |
B£® | AgNO3 | CuSO4 |
C£® | FeSO4 | Al2(SO4)3 |
D£® | CuSO4 | AgNO3 |
A. AB. BC. CD. D

