题目内容
【题目】硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO2(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:____________________________。
②方法2:用氢氧化钠溶液将SO2转化为NaHSO3,再氧化为 Na2SO4。实验测得NaHSO3溶液中![]() = 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g)![]() H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将一定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(g) ![]() COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)
COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)![]() H2S(g)+ CO(g)的平衡常数K=__________。T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
H2S(g)+ CO(g)的平衡常数K=__________。T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为
 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
【答案】CaO(s)+SO2(g)==CaSO3(s) ΔH=-402.0kJ·mol-1 6bc466.7%0.42SO42--2e-=S2O82-
【解析】
由盖斯定律可得CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式;由Ka1×Ka2计算溶液中c(H+);在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态;恒容条件下,容器体积不变,混合气体质量不变,混合气体的密度不变;逆反应化学平衡常数为正反应化学平衡常数的倒数;依据题给条件建立三段式,运用化学平衡常数计算COS得消耗量;
(1)①由盖斯定律,a+b/2-c/2得CaO(S)+SO2(g)=CaSO3(S)ΔH=-402.0kJ/mol;②NaHSO3溶液中Ka1×Ka2=![]() ,由题给数据可得1.5×10-2×1.0×10-7
,由题给数据可得1.5×10-2×1.0×10-7
=1500×c2(H+),解得c(H+)=1.0×10-7mol/L,则pH为6。(2)①各物质的物质的量浓度保持不变是反应达到平衡的标志;恒温条件下,化学平衡常数为定值;形成H-S键代表正反应速率,形成H-H键代表逆反应速率,形成2molH-S键的同时形成1mol H-H键说明正、逆反应速率相等。②逆反应化学平衡常数为正反应化学平衡常数的倒数,正反应化学平衡常数K=0.25,则逆反应的化学平衡常数K1=1/K=4;达到平衡时COS的转化率为x,设由题给数据建立如下三段式:
COS(g) + H2(g) ![]() H2S(g) + CO(g)
H2S(g) + CO(g)
c(起) 0.1mol/L 0.1mol/L 0 0
c(变) 0.1xmol/L 0.1xmol/L 0.1xmol/L 0.1xmol/L
c(平) (0.1-0.1x) mol/L (0.1-0.1x) mol/L 0.1xmol/L 0.1xmol/L
由化学平衡常数可得:![]() =4,解得x=2/3。(3)①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,S2O82-中S元素化合价为+7价,设1mol S2O82-能氧化的Mn2+的物质的量为a,由得失电子数目守恒可得:1mol×2×(7-6)=a×(7-2),解得a=0.4 mol;电解硫酸和硫酸铵混合溶液的电解池中,阳极是SO42-失电子发生氧化反应的过程,电极反应式为:2SO42--2e-=S2O82-。
=4,解得x=2/3。(3)①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,S2O82-中S元素化合价为+7价,设1mol S2O82-能氧化的Mn2+的物质的量为a,由得失电子数目守恒可得:1mol×2×(7-6)=a×(7-2),解得a=0.4 mol;电解硫酸和硫酸铵混合溶液的电解池中,阳极是SO42-失电子发生氧化反应的过程,电极反应式为:2SO42--2e-=S2O82-。

【题目】如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是
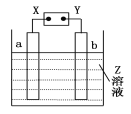
a极板 | b极板 | X电极 | Z | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A. A B. B C. C D. D






