题目内容
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大。
是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大。![]() 、
、![]() 、
、![]() 三种元素原子的最外层电子数相同,
三种元素原子的最外层电子数相同,![]() 与
与![]() 能够形成原子之比为
能够形成原子之比为![]() 的化合物
的化合物![]() ,
,![]() 是前四周期基态原子含有未成对电子数目最多的元素,
是前四周期基态原子含有未成对电子数目最多的元素,![]() 与
与![]() 形成的晶体
形成的晶体![]() 结构如图所示。试用元素符号回答下列问题:
结构如图所示。试用元素符号回答下列问题:
(1)![]() 、
、![]() 、
、![]() 三种元素的电负性由大到小的顺序为_______。
三种元素的电负性由大到小的顺序为_______。
(2)![]() 与
与![]() 两种元素能够形成两种常见的化合物,则在这两种化合物分子中,原子的杂化方式分别为______和______,且这两种分子____(填选项)。
两种元素能够形成两种常见的化合物,则在这两种化合物分子中,原子的杂化方式分别为______和______,且这两种分子____(填选项)。
A 都是极性分子 B 都是非极性分子 C 其中一种是极性分子另一种是非极性分子
(3)![]() 元素处于周期表的____区,其单质晶体堆积模型的名称为_____。
元素处于周期表的____区,其单质晶体堆积模型的名称为_____。
(4)![]() 元素的基态原子价层电子排布图为______。
元素的基态原子价层电子排布图为______。
(5)已知![]() 能溶于某浓度的硝酸中,得到蓝色溶液的同时,会逸出一种与
能溶于某浓度的硝酸中,得到蓝色溶液的同时,会逸出一种与![]() 互为等电子体的纯净气体,则该反应的化学方程式为_____。经研究证实,所得溶液呈蓝色,是因为溶液中含有由
互为等电子体的纯净气体,则该反应的化学方程式为_____。经研究证实,所得溶液呈蓝色,是因为溶液中含有由![]() 、
、![]() 、
、![]() 三种元素形成的一种配位离子,试写出该离子的结构式______。
三种元素形成的一种配位离子,试写出该离子的结构式______。
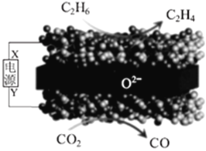
(6)由晶体![]() 的晶胞可知,
的晶胞可知,![]() 离子呈简单立方堆积模型,形成立方体空隙,则
离子呈简单立方堆积模型,形成立方体空隙,则![]() 离子对这些立方体空隙的填充率为_____
离子对这些立方体空隙的填充率为_____![]() 。
。
【答案】![]()
![]()
![]()
![]()
![]() 面心立方最密堆积
面心立方最密堆积 
![]()
 50
50
【解析】
![]() 是前四周期基态原子含有未成对电子数目最多的元素,则D为Cr元素;
是前四周期基态原子含有未成对电子数目最多的元素,则D为Cr元素;![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大,Cr是第四周期,所以E也是第四周期,那么A、B、C为前三周期,则A为H元素;
是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大,Cr是第四周期,所以E也是第四周期,那么A、B、C为前三周期,则A为H元素;![]() 、
、![]() 、
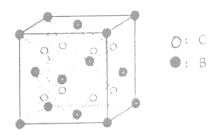
、![]() 三种元素原子的最外层电子数相同,则C为Na元素,E为Cu元素;由图可知晶体
三种元素原子的最外层电子数相同,则C为Na元素,E为Cu元素;由图可知晶体![]() 每个晶胞中含有B个数为
每个晶胞中含有B个数为![]() ,C的个数为8,且B在第二周期,故B为O元素;综上所述,A、B、C、D、E分别为H、O、Na、Cr、Cu。
,C的个数为8,且B在第二周期,故B为O元素;综上所述,A、B、C、D、E分别为H、O、Na、Cr、Cu。
(1)根据分析,A、B、C分别为H、O、Na,H和O为非金属,电负性大于金属Na,且O的电负性大于H的电负性,故有电负性![]() ;
;
(2)H和O组成的化合物有H2O和H2O2,两种物质中O元素形成的都是单键,故都是sp3杂化;H2O分子空间构型为V型,正负电荷中心不重合,是极性分子,H2O2空间构型为折线形( ),正负电荷中心不重合,也是极性分子,故选A;
),正负电荷中心不重合,也是极性分子,故选A;
(3)Cu元素处于周期表的ds区,Cu晶体的晶胞中,每一个面心和八个顶点上都有一个Cu原子,是典型的面心立方最密堆积;
(4)Cr是第24号元素,核外电子排布式属于洪特规则的特例,为[Ar]3d54s1,它的基态原子价层电子排布图为 ;
;
(5)根据分析,X为CuH。CuH与硝酸发生氧化还原反应,硝酸被还原后生成的气体为氮的氧化物,该气体与![]() 互为等电子体,故该气体为N2O,CuH与硝酸反应的化学方程式为:
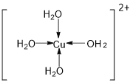
互为等电子体,故该气体为N2O,CuH与硝酸反应的化学方程式为:![]() ;H、O、Cu形成配合物,Cu2+提供空轨道,由H、O 形成的H2O提供孤对电子,形成四水合铜离子为蓝色,该离子的结构式为
;H、O、Cu形成配合物,Cu2+提供空轨道,由H、O 形成的H2O提供孤对电子,形成四水合铜离子为蓝色,该离子的结构式为 ;
;
(6)Na+呈简单立方堆积模型,形成立方体空隙有8个,O2-占有4个,所以O2-对这些立方体空隙的填充率为50%;

 习题精选系列答案
习题精选系列答案【题目】依据信息写出下列反应的方程式或填充合适的物质。
⑴氢氧化铟[In(OH)3]广泛应用于电子行业。以氧化铟废渣(主要含In2O3和Fe3O4)为原料制备氢氧化铟的一种工艺流程如下:
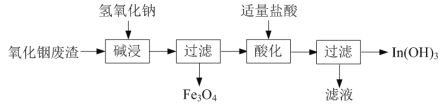
已知:In2O3为两性氧化物,在强碱性条件下In元素以InO33-离子形式存在。
①写出“碱浸”时反应的离子方程式:______。
②写出“酸化”时反应的离子方程式:______。
⑵下表所示为部分酸的电离平衡常数:
酸 | H2SO3 | CH3COOH | HCOOH |
电离平衡常数 | Ka1=1.2×10-2 Ka2=5.6×10-8 | 1.75×10-5 | 1.8×10-4 |
从H2SO3、CH3COOH中选择合适的物质,以实现HCOONa→HCOOH的转化,写出该反应的离子方程式:______。
⑶下表所示为部分物质的溶度积常数:
难溶物 | Mn(OH)2 | Co(OH)2 | MnCO3 |
溶度积常数 | 2×10-13 | 5.9×10-15 | 2.2×10-11 |
①从NaOH、Co(OH)2中选取合适的物质,填在如下转化关系中:MnCl2→Mn(OH)2。______
②NaNO3、Na2CO3中选择合适的物质,填在如下转化关系中:MnCl2→NaCl。_______