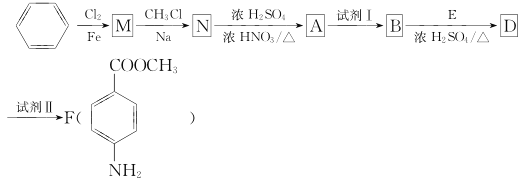
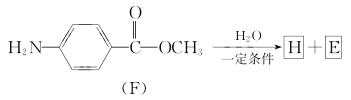题目内容
【题目】氧化铜、氯化亚铜是重要的化工原料,广泛用作有机合成的催化剂。
Ⅰ.实验室用右图所示装置,利用还原铜粉和氯气来制备氧化铜。

(1)石棉绒的作用是_______________。
(2)装置B中的试剂是_______________。
(3)所得产品中CuCl2的质量分数为90%,则其中可能含有的杂质是_______________(写一种即可)。
Ⅱ.另取纯净CuCl2固体用于制备CuCl。

(4)操作①中加入盐酸的目的主要是_______________。
(5)操作②中反应的离子方程式为_______________。
(6)操作①中若用10mol/L盐酸代替0.2mol/L盐酸,再通入SO2后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:c(H+)过大导致白色沉淀溶解。
为验证此猜想,取75gCuCl2固体、100mL0.2mol/L盐酸及_______________mL9.8mol/LH2SO4配制成200mL溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:c(Cl-)过大导致白色沉淀溶解。
[资料显示:存在平衡2Cl-(aq)+CuCl(s)![]() CuCl32-(aq)]
CuCl32-(aq)]
请设计实验说明该猜想是否成立:________________。
【答案】 增大铜粉与氯气的接触面积 NaOH溶液 Cu或CuCl或石棉绒 Cu2++2H2O![]() Cu(OH)2+2H+ 酸抑制Cu2+的水解 2Cu2++SO2+2Cl-+2H2O=SO42-+2CuC1↓+4H+ 50 取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立。
Cu(OH)2+2H+ 酸抑制Cu2+的水解 2Cu2++SO2+2Cl-+2H2O=SO42-+2CuC1↓+4H+ 50 取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立。
【解析】(1)石棉绒的作用是增大铜粉与氯气的接触面积;正确答案:增大铜粉与氯气的接触面积。
(2) 氯气有毒, 可用氢氧化钠溶液吸收,所以B装置是吸收尾气;正确答案:NaOH溶液。 (3)根据反应前后元素守恒规律:氯气和铜反应除了生成CuCl2外,还可能有CuCl生成,还可能有铜剩余,或有石棉绒夹杂;因此可能含有的杂质是Cu或CuCl或石棉绒;正确答案:Cu或CuCl或石棉绒。
Ⅱ.(4) 因为氯化铜是强酸弱碱盐,溶液中存在Cu2++2H2O![]() Cu(OH)2+2H+ ,所以溶解时加入HCl溶液,抑制氯化铜的水解;正确答案:Cu2++2H2O
Cu(OH)2+2H+ ,所以溶解时加入HCl溶液,抑制氯化铜的水解;正确答案:Cu2++2H2O![]() Cu(OH)2+2H+ 酸抑制Cu2+的水解。
Cu(OH)2+2H+ 酸抑制Cu2+的水解。
(5) 操作②为向含有铜离子、氯离子的溶液中通入二氧化硫气体,生成CuC1沉淀,反应为2Cu2++SO2+2Cl-+2H2O=SO42-+2CuC1↓+4H+ ;正确答案:2Cu2++SO2+2Cl-+2H2O=SO42-+2CuC1↓+4H+↓。
(6)设9.8mol/LH2SO4的体积为VmL,则0.2×0.1+V×9.8×2=10×0.1, 解之得V=50mL;体系中存在平衡2Cl-(aq)+CuCl(s)![]() CuCl32-(aq),溶液中氯离子的浓度过大平衡正向移动,可以取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立;正确答案:50;取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立。
CuCl32-(aq),溶液中氯离子的浓度过大平衡正向移动,可以取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立;正确答案:50;取少量白色沉淀加入到饱和氯化钠溶液中,搅拌,若白色沉淀溶解,说明猜想二成立,反之不成立。