题目内容
18.4 g NaOH和NaHCO3固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却后称得剩余固体质量为16.6 g,计算原混合物中NaOH的质量分数。
54.3%
NaOH和NaHCO3的固体混合物在加热条件下,先发生酸式盐和碱的中和反应:
NaHCO3+NaOH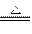 Na2CO3+H2O↑ ①
Na2CO3+H2O↑ ①
若NaOH过量,则只发生反应①;若NaHCO3过量,则过量的NaHCO3继续受热分解,发生反应:
2NaHCO3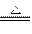 Na2CO3+H2O↑+CO2↑ ②
Na2CO3+H2O↑+CO2↑ ②
因此,计算前,必须先根据反应①的质量差判断NaHCO3是否过量。
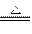 Na2CO3+H2O↑ Δm
Na2CO3+H2O↑ Δm
124 18
18.4 g x
解得 x="2.67" g
若实际质量差="2.67" g,则NaHCO3、NaOH恰好完全反应;
若实际质量差>2.67 g,则NaHCO3过量,发生反应①和②;
若实际质量差<2.67 g,则NaOH过量,只发生反应①。
现实际固体质量差为18.4 g-16.6 g="1.8" g<2.67 g,则NaOH过量,按不足量的NaHCO3计算。设NaHCO3质量为y。
NaHCO3+NaOH====Na2CO3+H2O↑ Δm
84 18
y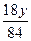
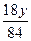 ="18.4" g-16.6 g="1.8" g
="18.4" g-16.6 g="1.8" g
解得 y="8.4" g
m(NaOH)="18.4" g-8.4 g="10.0" g
w(NaOH)=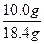 ×100%=54.3%。
×100%=54.3%。
NaHCO3+NaOH
 Na2CO3+H2O↑ ①
Na2CO3+H2O↑ ①若NaOH过量,则只发生反应①;若NaHCO3过量,则过量的NaHCO3继续受热分解,发生反应:
2NaHCO3
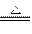 Na2CO3+H2O↑+CO2↑ ②
Na2CO3+H2O↑+CO2↑ ②因此,计算前,必须先根据反应①的质量差判断NaHCO3是否过量。
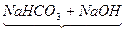
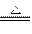 Na2CO3+H2O↑ Δm
Na2CO3+H2O↑ Δm124 18
18.4 g x
解得 x="2.67" g
若实际质量差="2.67" g,则NaHCO3、NaOH恰好完全反应;
若实际质量差>2.67 g,则NaHCO3过量,发生反应①和②;
若实际质量差<2.67 g,则NaOH过量,只发生反应①。
现实际固体质量差为18.4 g-16.6 g="1.8" g<2.67 g,则NaOH过量,按不足量的NaHCO3计算。设NaHCO3质量为y。
NaHCO3+NaOH====Na2CO3+H2O↑ Δm
84 18
y
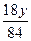
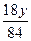 ="18.4" g-16.6 g="1.8" g
="18.4" g-16.6 g="1.8" g解得 y="8.4" g
m(NaOH)="18.4" g-8.4 g="10.0" g
w(NaOH)=
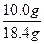 ×100%=54.3%。
×100%=54.3%。
练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
 O,通常用NaNO
O,通常用NaNO 4Na
4Na