��Ŀ����
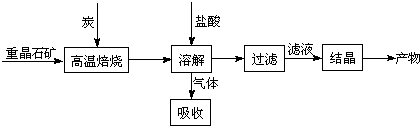
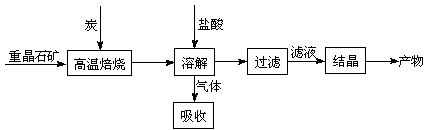
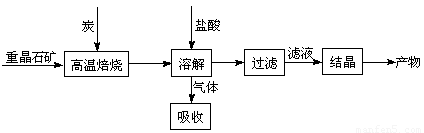
��10�֣���ҵ���Ʊ�BaCl2�Ĺ�������ͼ���£�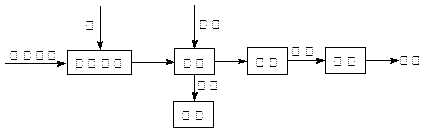
ij�о�С����ʵ�������ؾ�ʯ����Ҫ�ɷ�BaSO4���Թ�ҵ���̽���ģ��ʵ�顣�����
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) ��H1 =" 571.2" kJ��mol-1 ��
4CO(g) + BaS(s) ��H1 =" 571.2" kJ��mol-1 ��
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) ��H2=" 226.2" kJ��mol-1 ��
2CO2(g) + BaS(s) ��H2=" 226.2" kJ��mol-1 ��
��1�������ù���NaOH��Һ����,�õ����ơ�Na2Sˮ������ӷ���ʽΪ ��
��2����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱ��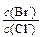 = ��
= ��
[Ksp(AgBr)=5.4��10-13��Ksp(AgCl)=2.0��10-10]
��3����ӦC(s) + CO2(g) 2CO(g)�ġ�H2= kJ��mol-1��
2CO(g)�ġ�H2= kJ��mol-1��
��4��ʵ�������б�����������̿��ͬʱ��Ҫͨ���������Ŀ����
�� ��
��1��S2- + H2O HS- +OH- HS- + H2O
HS- +OH- HS- + H2O H2S +OH-���ɲ�д��
H2S +OH-���ɲ�д��
��2��2.7��10-3
��3��172.5
��4��ʹBaSO4�õ���ֵĻ�ԭ�������BaS�IJ�����
�٢�Ϊ���ȷ�Ӧ��̿��������Ӧ����ά�ַ�Ӧ�������
������1���������屻�����������յõ����ƣ�������Һ��Ϊˮ���Լ��ԣ���ˮ�ⷽ��ʽע��ֲ��Ϳ��档S2����H2O HS����OH����HS����H2O
HS����OH����HS����H2O H2S��OH�����ڶ���ˮ��̶Ƚ�С�����Բ�д��
H2S��OH�����ڶ���ˮ��̶Ƚ�С�����Բ�д��
��2����AgBr��AgCl����ʱ����Һ��Ag+Ũ�ȹ̶�������Br����Cl��Ũ��֮��Ϊ�����ܶȻ�֮�ȣ���
c(Br��):c(Cl��)=��5.4��10-13������2.0��10-10��=2.7��10-3��
��3����������Ȼ�ѧ����ʽ��˹���ɽ������㣬����ʽ�������ã���-�ڣ�/2�õ�����H=����-�ڣ�/2=172.5kJ/mol��
��4�����з�Ӧ��Ϊ���ȷ�Ӧ������������Ҫ�ṩ����������ɣ����������Խ���������̼������ȼ��Ϊ�����ṩ������ά�ָ���������

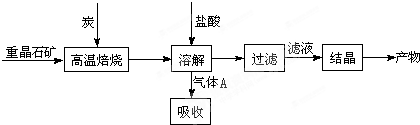
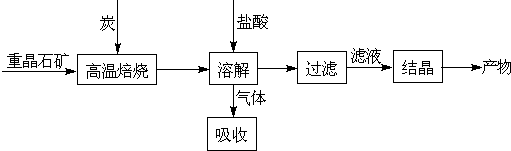
 4CO(g) + BaS(s) ��H1 ����571.2 kJ��mol-1 ��
4CO(g) + BaS(s) ��H1 ����571.2 kJ��mol-1 ��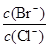 ��
��[Ksp(AgBr)��5.4��10-13��Ksp(AgCl)��2.0��10-10]
��
��[Ksp(AgBr)��5.4��10-13��Ksp(AgCl)��2.0��10-10]