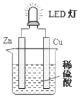
��Ŀ����
����Ŀ����������(NaN3)��һ����ɫ���壬�㷺����������ȫ���Ҽ������ϳɵȣ������������Ʊ�����Ϊ��
2NaNH2+N2O�TNaN3+NaOH+NH3��
3NaNH2+NaNO3�TNaN3+3NaOH+NH3��
(1)�ٵ�ԭ�ӵ�L������Ų�ͼ_____________________��
�ڵ����ڵ������У���һ����������Ԫ��Ϊ_____________����Ԫ�ط��ţ���
����N3��Ϊ�ȵ����������Ϊ____________��д��һ�֣���
�ܰ����ĵ���ʽ____________��
(2)NH3�е㣨��33.34�棩��N2O�е㣨��88.49�棩�ߣ�����Ҫԭ����____________
(3)���ݼ۲���ӶԻ������ۣ�NO3-�乹�ͳ�__________����
(4)������ȫ���ҵ�����ǻ��ڷ�Ӧ6NaN3+Fe2O3�T3Na2O+2Fe+9N2�����������е�����һ�ֳ������ʣ������ľ��������ֶѻ���ʽ���������ֵĶѻ���ʽ��ͼ��ʾ�������й����������˵������ȷ����_________��
A���������ĵ�����������ͨ��ʱ���������ɵ����������ƶ�
B������Fe���é�Fe�Ķѻ���ʽ�ֱ���غ�ͭ��ͬ
C���ռ�����������Fe�����é�Fe
D���������ڲ����ڽ�����
(5)�����������־��壨����Fe���é�Fe�����ܶȱ�ֵΪ___________����д��С��������2λ��Ч���֣�

���𰸡�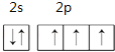 Ne CO2��
Ne CO2��  �������Ӽ������� ƽ������ BD 0.92
�������Ӽ������� ƽ������ BD 0.92
��������
(1)�ٵ���7��Ԫ�أ�ԭ�Ӻ��������Ϊ7����������Ų���2��5��ԭ�ӵ�L������5��������2s�ܼ�����2�����ӡ�2p�ܼ�����3�����ӣ������������ԭ�������ع����ﲻ����ԭ��֪����L������Ų�ͼΪ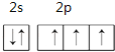 ��
��
��N�ǵڶ����ڵ�Ԫ�أ���ͬһ�����У�Ԫ�ص�һ����������ԭ����������������������ƣ�����IIA�塢��VA��Ԫ�ش�������Ԫ�أ����Եڶ�����Ԫ���е�һ�����������Ƕ�������Ԫ��Ne��
�ۼ۵�������ȡ�ԭ�Ӹ�����ȵ�������ȵ����壬����N3��Ϊ�ȵ������������CO2��N2O�ȣ�
�ܰ��������е�ԭ�Ӻ�ÿ����ԭ��֮�䶼����һ�����õ��Ӷԣ���ԭ���ϻ���һ�Թ¶Ե��ӣ����������ӵĵ���ʽΪ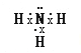 ��
��
(2)NH3�д��������N2O�в��������������֮������Ĵ��ڣ������˷���֮�����������ʹ�����ۻ���������Ҫ�ϸߵ�����������NH3�е㣨-33.34�棩��N2O�е㣨-88.49�棩�ߣ�
(3)NO3-�м۲���ӶԸ���=3+(5+1-3��2)/2=3�Ҳ����µ��Ӷԣ�������ռ乹��Ϊƽ�������Σ�
(4)A���������ĵ�����������ͨ��ʱ���ɵ����������ƶ������Ӳ���ͨ��Ų����ģ���ѡ��A����
B����-Fe����-Fe�Ķѻ���ʽ�ֱ���غ�ͭ��ͬ����-FeΪ���������ѻ�����-FeΪ���������ѻ�����ѡ��B��ȷ��
C������Fe�����־����Ϸ�ʽ��֪���ռ������ʦ�-FeС�ڦ�-Fe����ѡ��C����
D�����������д��ڽ����������Խ������ڲ����ڽ���������ѡ��D��ȷ��
��˺���ѡ����BD��
(5)��-Fe��Feԭ�Ӹ���=![]() =2����-Fe��Feԭ�Ӹ���=
=2����-Fe��Feԭ�Ӹ���=![]() =4����Feԭ�Ӱ뾶Ϊr����-Fe�о����߳�=
=4����Feԭ�Ӱ뾶Ϊr����-Fe�о����߳�=![]() ����-Fe�о����ı߳�=
����-Fe�о����ı߳�=![]() �������ܶȹ�ʽ�ɵ���-Fe���ܶ�
�������ܶȹ�ʽ�ɵ���-Fe���ܶ�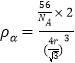 ����-Fe���ܶ�Ϊ
����-Fe���ܶ�Ϊ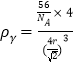 ���������ܶ�֮��Ϊ
���������ܶ�֮��Ϊ![]() =
=![]() ��
��![]() =0.92
=0.92

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����Ȼ���е����ʾ�������Ի�������ʽ���ڣ�Ϊ�˱����о������ã�����Ի������з�����ᴿ������A��B��C��D����ѧ�����Ļ���������ᴿ��װ�á�

I������ݻ���������ᴿ��ԭ�����ش�������ʵ������Ҫʹ������װ�á���A��B��C��D�����ʵ��Ŀո��С�
��1��̼�������Һ�з����̼���_____��
��2���Ȼ�����Һ�з�����Ȼ���____��
��3������ֲ���ͺ�ˮ____��
��4����ˮ����___��
��5����ȥ����ˮ�е�Cl��������____��
��6���ӵ�ˮ�з����I2____��
II����ˮ����ȡ�ⵥ�ʵķ������£�
��1����ȡ��Һ
�����п���Ϊ��ˮ����ȡ�ⵥ����ȡ������____
A���ƾ� B����
�ڷ�Һ©����ʹ��ǰ������____
�۲����ϵ�֪������H2O��>��������>�����ƾ��������â�����ѡ��ȡ����ȡ��ˮ�еĵⵥ�ʣ���Һʱ���ϲ�Һ����___ɫ��
��2������
��װ��A��a��������___��a�м�������___��ֹ����ʱҺ�屩�С�����װ��������ˮӦ��____�ڽ�����������������������
����֪������Ȼ�̼���۷е��������
�۵� | �е� | |
�� | 113.7�� | 184.3�� |
���Ȼ�̼ | -22.6�� | 76.8�� |
���������������Ȼ�̼�Ļ�����ƿ�����ռ��������ʵ�������______��
��ˮ���̲��ŷḻ����Դ����ʵ������ȡ������ˮ�������������̵�ʵ�飺
[��ˮ]![]() [����]
[����]![]() [ʳ��ˮ]��[�Ȼ��ƾ���]
[ʳ��ˮ]��[�Ȼ��ƾ���]
����һ�������к�Ca2+��Mg2+��SO42�������ʣ���Ҫ�ᴿ������ۺ����á������ᴿ�IJ����У�
�ټ��������Na2CO3��Һ �ڼ��������BaCl2��Һ �ۼ��������NaOH��Һ �ܵ�����Һ��pH����7 ���ܽ� ���� ����������ȷ�IJ���˳����____����ѡ����ĸ��
a���ݢڢۢ٢ޢܢ� b���ݢ٢ڢۢޢܢ�
c���ݢڢ٢ۢܢޢ� d���ݢۢڢ٢ޢܢ�
��������������е�____ʱ��ֹͣ���ȡ�
�������������к���������ɳ��CaCl2��MgCl2�������Σ��������ܽ���ȹ��˽���ɳ��ȥ���ټ�����Һ�е�SO42������μ���ijδ֪��Һ�е�SO42��___��