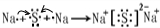题目内容
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体.请回答下列问题:
(1)B、D在周期表中同处在______族,B的原子结构示意图是______,下列可以验证B与D两元素原子得电子能力强弱的实验事实是______(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的原子的电子层数
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢化合的难易
(2)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式______:
(3)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有l0个电子,则甲与乙反应的离子方程式为______;
(4)D元素的气态氢化物和其低价氧化物能反应生成D的单质.该反应中氧化产物与还原产物的物质的量之比为______.
【答案】分析:A、B、C、D原子序数依次增大短周期元素,A、C及B、D分别是同一主族元素,确定B、D在在二、三周期;由于B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,确定A、C在一、三周期,所以A为氢、C为钠、B为氧、D为硫.
(1)根据最外层电子数确定B、D在周期表中同处在哪一族;根据核外电子排布画出B的原子结构示意图;非金属性越强得电子能力越强,非金属元素的非金属性强弱可以从以下几方面判断:①气态氢化物的稳定性强弱判断②最高价氧化物的水化物的酸性强弱判断③与氢气反应的难易程度判断④电负性性的大小等;.
(2)同时含有这四种元素的物质属于酸式盐,两种酸式盐反应且生成气体,只能是强酸酸式盐和弱酸酸式盐反应,强酸酸式盐起酸的作用,再根据反应物和生成物及离子方程式的书写规则写出相应的离子方程式.
(3)根据题干A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有l0个电子知,甲为HS-,乙为OH-,酸式酸根离子与氢氧根离子发生中和反应;
(4)根据氧化还原反应确定氧化产物与还原产物的物质的量之比.
解答:解:根据四种短周期元素在周期表中的位置,原子序数依次增大,确定它们的位置为:A、C在一、三周期,B、D在在二、三周期,且A、C在B、D的左边,则A为A为氢、C为钠;利用B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,B为氧、D为硫.因A为氢、B为氧、C为钠、D为硫,所以元素符号分别为:H、O、Na、S.
(1)在主族元素中,元素的最外层电子数与族序数相等,所以B、D在周期表中同处在ⅥA;B的原子结构示意图为 ;非金属性越强得电子能力越强,非金属元素的非金属性强弱可以从以下几方面判断:①气态氢化物的稳定性强弱判断②最高价氧化物的水化物的酸性强弱判断③与氢气反应的难易程度判断④电负性性的大小④根据元素周期律判断,同主族元素,随着原子序数的增大,非金属性逐渐减弱等,所以选BCD,
;非金属性越强得电子能力越强,非金属元素的非金属性强弱可以从以下几方面判断:①气态氢化物的稳定性强弱判断②最高价氧化物的水化物的酸性强弱判断③与氢气反应的难易程度判断④电负性性的大小④根据元素周期律判断,同主族元素,随着原子序数的增大,非金属性逐渐减弱等,所以选BCD,
故答案为:ⅥA;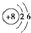 ; BCD;
; BCD;
(2)同时含有这四种元素的物质属于酸式盐,两种酸式盐反应且生成气体,只能是强酸酸式盐和弱酸酸式盐反应,强酸酸式盐起酸的作用,所以是硫酸氢钠和亚硫酸氢钠反应生成水和二氧化硫、硫酸钠,硫酸氢钠电离出钠离子、氢离子和硫酸根离子,亚硫酸氢钠电离出钠离子、亚硫酸氢根离子,所以离子方程式为HSO3-+H+═H2O+SO2↑.
故答案为:HSO3-+H+═H2O+SO2↑;
(3)根据题意知,甲为HS-,乙为OH-,所以离子方程式为HS-+OH-═S2-+H2O,故答案为:HS-+OH-═S2-+H2O;
(4)硫化氢和二氧化硫反应生成硫和水,硫化氢中的硫显-2价,二氧化硫中的硫显+4价,所以得失电子的最小公倍数为4,所以硫化氢的计量数为2,二氧化硫的计量数为1,硫化氢对应的产物硫是氧化产物,二氧化硫对应的产物硫是还原产物,所以是2:1,故答案为:2:1.
点评:本题较难,考查学生利用原子的结构来推断元素,注意本题中A、C与B、D可能存在情况来分析是解答本题的难点,然后结合元素化合物知识即可解答.
(1)根据最外层电子数确定B、D在周期表中同处在哪一族;根据核外电子排布画出B的原子结构示意图;非金属性越强得电子能力越强,非金属元素的非金属性强弱可以从以下几方面判断:①气态氢化物的稳定性强弱判断②最高价氧化物的水化物的酸性强弱判断③与氢气反应的难易程度判断④电负性性的大小等;.
(2)同时含有这四种元素的物质属于酸式盐,两种酸式盐反应且生成气体,只能是强酸酸式盐和弱酸酸式盐反应,强酸酸式盐起酸的作用,再根据反应物和生成物及离子方程式的书写规则写出相应的离子方程式.
(3)根据题干A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有l0个电子知,甲为HS-,乙为OH-,酸式酸根离子与氢氧根离子发生中和反应;
(4)根据氧化还原反应确定氧化产物与还原产物的物质的量之比.
解答:解:根据四种短周期元素在周期表中的位置,原子序数依次增大,确定它们的位置为:A、C在一、三周期,B、D在在二、三周期,且A、C在B、D的左边,则A为A为氢、C为钠;利用B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,B为氧、D为硫.因A为氢、B为氧、C为钠、D为硫,所以元素符号分别为:H、O、Na、S.
(1)在主族元素中,元素的最外层电子数与族序数相等,所以B、D在周期表中同处在ⅥA;B的原子结构示意图为
 ;非金属性越强得电子能力越强,非金属元素的非金属性强弱可以从以下几方面判断:①气态氢化物的稳定性强弱判断②最高价氧化物的水化物的酸性强弱判断③与氢气反应的难易程度判断④电负性性的大小④根据元素周期律判断,同主族元素,随着原子序数的增大,非金属性逐渐减弱等,所以选BCD,
;非金属性越强得电子能力越强,非金属元素的非金属性强弱可以从以下几方面判断:①气态氢化物的稳定性强弱判断②最高价氧化物的水化物的酸性强弱判断③与氢气反应的难易程度判断④电负性性的大小④根据元素周期律判断,同主族元素,随着原子序数的增大,非金属性逐渐减弱等,所以选BCD,故答案为:ⅥA;
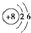 ; BCD;
; BCD;(2)同时含有这四种元素的物质属于酸式盐,两种酸式盐反应且生成气体,只能是强酸酸式盐和弱酸酸式盐反应,强酸酸式盐起酸的作用,所以是硫酸氢钠和亚硫酸氢钠反应生成水和二氧化硫、硫酸钠,硫酸氢钠电离出钠离子、氢离子和硫酸根离子,亚硫酸氢钠电离出钠离子、亚硫酸氢根离子,所以离子方程式为HSO3-+H+═H2O+SO2↑.
故答案为:HSO3-+H+═H2O+SO2↑;
(3)根据题意知,甲为HS-,乙为OH-,所以离子方程式为HS-+OH-═S2-+H2O,故答案为:HS-+OH-═S2-+H2O;
(4)硫化氢和二氧化硫反应生成硫和水,硫化氢中的硫显-2价,二氧化硫中的硫显+4价,所以得失电子的最小公倍数为4,所以硫化氢的计量数为2,二氧化硫的计量数为1,硫化氢对应的产物硫是氧化产物,二氧化硫对应的产物硫是还原产物,所以是2:1,故答案为:2:1.
点评:本题较难,考查学生利用原子的结构来推断元素,注意本题中A、C与B、D可能存在情况来分析是解答本题的难点,然后结合元素化合物知识即可解答.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案
相关题目
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为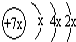 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为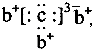 下列比较中正确的是( )
下列比较中正确的是( )
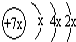 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为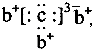 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
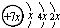 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:

 Al(OH)3+OH-
Al(OH)3+OH-