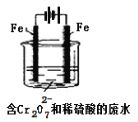
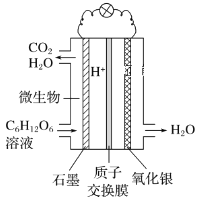
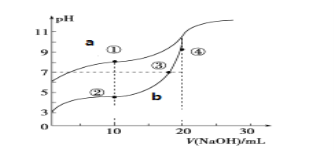
题目内容
【题目】充满NO2和O2混合气体30mL的试管倒立于水中,最终试管中剩余5mL气体,则原试管中NO2和O2的体积比可能是
A.1︰1B.3︰1C.5︰1D.9︰1
【答案】D
【解析】
NO2和O2混合气体与水可能的反应式有:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,根据反应的方程式利用讨论的方法进行计算原混合气体中NO2和O2的体积。
若氧气过量,则剩余5mL气体为氧气,设参加反应的氧气的体积为x,则:
![]()
4x+x=30mL5mL=25mL,x=5mL,所以氧气的体积为:5mL+5mL=10mL,二氧化氮体积为:30mL10mL=20mL,NO2和O2的体积比=2:1;
若剩余5mL气体为NO,设氧气的体积为y,
![]()

![]() ,则y=3mL,则氧气体积为3mL,二氧化氮体积为:30mL3mL=27mL,NO2和O2的体积比=9:1,答案选D。
,则y=3mL,则氧气体积为3mL,二氧化氮体积为:30mL3mL=27mL,NO2和O2的体积比=9:1,答案选D。

练习册系列答案
相关题目