题目内容
【题目】短周期元素W、X、Y、Z的原子序数依次增加。
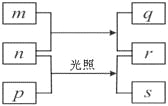
① m、p、r是由这些元素组成的二元化合物;
② n是元素Z的单质,通常为黄绿色气体;
③ q具有强氧化性,q的水溶液常用于漂白和杀菌;
④ 0.01 mol·L1r溶液的pH为2,p是最简单的有机物,s通常是难溶于水的混合物。
上述物质的转化关系如图所示,回答下列问题。
(1)Y原子的结构示意简图是 。
(2)X、Y、Z的原子半径由大到小的顺序是 (用元素符号表示)。
(3)r的电子式为 ;物质n的用途有 (任写一种即可)。
(4)q与等物质的量的NaOH反应后得到的溶液呈碱性的原因是 (用离子方程式表示)。
(5)W、X、Y按原子个数比为2 :1 :1组成化合物t能与NaHCO3溶液反应产生气泡(质谱分析法测得t的相对分子质量为60),化合物t是 (写名称)。
(6)常温常压下2.4g的p完全燃烧放出133.6kJ的热量,该反应的热化学方程式是 。
【答案】(1)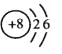 (2分)
(2分)
(2)r(Cl)>r(C)>r(O)(或Cl>C>O)(2分)
(3)![]() (2分);生产盐酸(生产漂白粉等合理答案均给分)(1分)
(2分);生产盐酸(生产漂白粉等合理答案均给分)(1分)
(4)ClO-+H2O![]() HClO+OH-(2分)(5)乙酸(或醋酸)(2分)
HClO+OH-(2分)(5)乙酸(或醋酸)(2分)
(6)CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.7kJ·mol-1(3分)
【解析】试题分析:短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物;n是元素Z的单质,通常为黄绿色气体,则n是氯气,Z是Cl;q具有强氧化性,q的水溶液常用于漂白和杀菌,因此q是次氯酸,则m是水,r是氯化氢,W是H;0.01 mol·L1r溶液的pH为2,p是最简单的有机物,p是甲烷,所以X是C,Y是O。s通常是难溶于水的混合物,属于甲烷的卤代烃。
(1)氧原子的结构示意简图是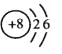 。
。
(2)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则X、Y、Z的原子半径由大到小的顺序是)r(Cl)> r(C)> r(O)。
(3)氯化氢是共价化合物,电子式为![]() ;氯气的用途有生产盐酸(生产漂白粉等)。
;氯气的用途有生产盐酸(生产漂白粉等)。
(4)次氯酸根离子水解,溶液显碱性,离子方程式为ClO-+ H2O![]() HClO+ OH-。
HClO+ OH-。
(5) W、X、Y按原子个数比为2 :1 :1组成化合物t能与NaHCO3溶液反应产生气泡(质谱分析法测得t的相对分子质量为60),化合物t是乙酸(或醋酸)。
(6)常温常压下2.4g甲烷是0.15mol,p完全燃烧放出133.6kJ的热量,所以1mol甲烷完全燃烧放出的热量是![]() ,因此该反应的热化学方程式是CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) △H = -890.7kJ·mol-1。
,因此该反应的热化学方程式是CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) △H = -890.7kJ·mol-1。