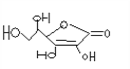
题目内容
【题目】用相同体积的0.1molL﹣1的BaCl2溶液,能分别使相同体积的Fe2(SO4)3、ZnSO4、Na2SO4溶液的SO42﹣完全沉淀,则三种溶液的物质的量浓度之比为( )
A.3:2:1
B.1:2:3
C.3:1:1
D.1:3:3
【答案】D
【解析】解:等体积等物质的量浓度的BaCl2溶液含有BaCl2的物质的量相同,由Ba2++SO42﹣=BaSO4↓可知生成BaSO4物质的量相同,令BaSO4的物质的量为3mol,则: n[Fe2(SO4)3]= ![]() n(BaSO4)=
n(BaSO4)= ![]() ×3mol=1mol,
×3mol=1mol,
n(ZnSO4)=n(BaSO4)=3mol,
n(K2SO4)=n(BaSO4)=3mol,
三种溶液的体积相同,物质的量浓度之比等于物质的量之比,故相同体积的Fe2(SO4)3、ZnSO4、K2SO4溶液的物质的量浓度之比为1mol:3mol:3molmol=1:3:3,
故选D.
等体积等物质的量浓度的BaCl2溶液含有BaCl2的物质的量相同,由Ba2++SO42﹣=BaSO4↓可知生成BaSO4物质的量相同,令BaSO4的物质的量为3mol,计算Fe2(SO4)3、ZnSO4、Na2SO4的物质的量,因三种溶液的体积相同,则物质的量之比等于其浓度之比.

练习册系列答案
相关题目