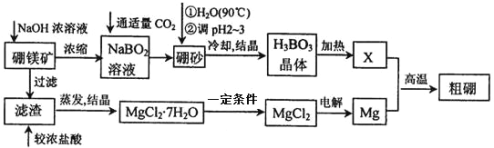
题目内容
【题目】
含氟化合物在生产生活中有重要的应用,回答下列问题:
(1)基态氟原子核外电子的运动状态有___________种,有___________种不同能量的原子轨道,其价层轨道表示式为___________。
(2)N与F可形成化合物N2F2,下列有关N2F2的说法正确的是___________(填字母)。
a.分子中氮原子的杂化轨道类型为sp2
b.其结构式为F-N≡N一F
c.其分子有两种不同的空间构型
d.1mol N2F2含有的σ键的数目为4NA
(3)NaHF2可用于制无水氟化氢和供雕刻玻璃、木材防腐等用。常温常压下为白色固体,易溶于水,160℃分解。NaHF2中所含作用力的类型有___________(填字母)。
a.离子键 b.共价键 c.配位键 d.氢键
(4)二氟甲烷(CH2F2)难溶于水,而三氟甲烷(CHF3)可溶于水,其可能的原因是___________。
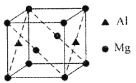
(5)氟化钙的晶胞结构如图所示。,晶胞中Ca2+离子的配位数为___________。与F-等距且最近的Ca2+形成的空间构型为___________。已知氟化钙的晶胞边长为a pm,其密度为pg·cm-3,则阿伏加德罗常数的数值为___________(列出计算式即可)。

【答案】9 3 ![]() ac abd 三氟甲烷中由于3个F原子的吸引使得C原子的正电性增强,从而三氟甲烷中的H原子可与H2O中的O原子之间形成氢键 8 正四面体
ac abd 三氟甲烷中由于3个F原子的吸引使得C原子的正电性增强,从而三氟甲烷中的H原子可与H2O中的O原子之间形成氢键 8 正四面体 ![]()
【解析】
(1)氟原子核外电子数为9,核外没有运动状态相同的电子。
(2)a.该分子中的氮氮键为共价双键,其中氮原子采取sp2杂化的方式。
b. 其结构式为F-N=N一F。
c. 此结构F-N=N一F有顺式反式之分。
d. 1mol N2F2含有的σ键的数目为3NA。
(3)NaHF2中所含作用力的类型有离子键,共价键,氢键。
(4)三氟甲烷中由于3个F原子的吸引使得C原子的正电性增强,从而三氟甲烷中的H原子可与H2O中的O原子之间形成氢键。
(5)根据均摊法计算。
(1)氟原子核外电子数为9,核外没有运动状态相同的电子,基态氟原子核外电子的运动状态有9种,核外电子排布为:1s22s22p5,有3种不同能量的原子轨道,价层轨道表示式为![]() ,故答案为:9;3;
,故答案为:9;3;![]() 。
。
(2)a.该分子中的氮氮键为共价双键,其中氮原子采取sp2杂化的方式,故a正确;
b. 其结构式为F-N=N一F,故b错误;
c. 此结构F-N=N一F有顺式反式之分,故c正确;
d. 1mol N2F2含有的σ键的数目为3NA,故d错误;
故选ac。
(3)NaHF2中所含作用力的类型有离子键,共价键,氢键,故答案为:abd。
(4)二氟甲烷(CH2F2)难溶于水,而三氟甲烷(CHF3)可溶于水,是由于三氟甲烷中由于3个F原子的吸引使得C原子的正电性增强,从而三氟甲烷中的H原子可与H2O中的O原子之间形成氢键,因此可溶于水,故答案为:三氟甲烷中由于3个F原子的吸引使得C原子的正电性增强,从而三氟甲烷中的H原子可与H2O中的O原子之间形成氢键。
(5)从氟化钙的晶胞结构可以看出Ca2+居于晶胞的顶点和面心,在每个Ca2+周围距离相等且最近的F-有8个,Ca2+离子的配位数为8,F-居于晶胞的八个小正方体的体心,在每个F-周围距离相等最近的Ca2+有4个,形成的空间构型为正四面体,在一个晶胞中含有Ca2+的数目为4,含有F-的数目为8,列式计算pg·cm-3×(a×10-10)3cm=4×78/NAg,所以NA=![]() ,故答案为:8;正四面体;
,故答案为:8;正四面体; ![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案