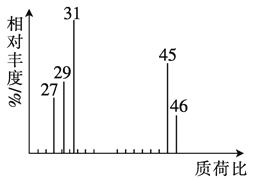
题目内容
【题目】甲、乙连个探究性学习小组,他们拟测定过氧化钠样品(含少量的Na2O)的纯度。
(1)甲组同学拟选用图l实验装置完成实验:

①写出实验中所发生主要反应的化学方程式____________
②该组同学必须选用的装置的连接顺序是:
A 接(____),(____)接(____), (____)接(____) (填接口字母,可不填满);
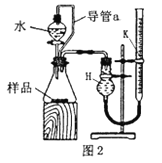
(2)乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了图2所示的实验装置。
①装置中导管a的作用:__________
②实验结束冷却至室温后,在读取量气管k中液面读数时,K中液面高于H中的液面,则测量结果将__________(偏高,不变或偏低),若有影响,应进行_________(操作)后再读效;
③若实验中样品的质量为mg,实验前后量气管k中液面读数分别为V0L、V1L(V0> V1换算成标况)。则样品的纯度为__________(含m、V0、V1的表达式)
(3)图2的装置可测定一定质量铜铁合金(不含其它元素)样品中铁的质量分数。分液漏斗中加入的试剂是__________.
【答案】 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑ E D G 空 水能顺利流下,消除由于加入水引起的氧气体积误差(后半句是重点) 偏低 向下移动量气管k,使k中液面与H中的液面相平 Na2O2%=195(V0-V1)/28m×100% 或者78(V0-V1)/11.2m×100% H2SO4(答案合理即可)
【解析】(1)①氧化钠和水反应生成氢氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为:Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑;
②装置的组装顺序:合金酸水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(G);
(2)①装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②在读取量气管k中液面读数时,K中液面高于H中的液面,说明气体的压强大于大气压强,气体体积偏小,物质的量偏小,导致测量结果将偏低,应向下移动量气管k,使k中液面与H中的液面相平后再读数;
③若实验中样品的质量为mg,实验前后量气管k中液面读数分别为V0L、V1L,过氧化钠和水反应生成的氧气物质的量=![]() mol,结合过氧化钠和水反应生成氧气的定量关系,2Na2O2~O2,计算得到过氧化钠质量得到过氧化钠含量为
mol,结合过氧化钠和水反应生成氧气的定量关系,2Na2O2~O2,计算得到过氧化钠质量得到过氧化钠含量为 ×100%=78(V0-V1)/11.2m×100%;
×100%=78(V0-V1)/11.2m×100%;
(3)利用图2的装置可测定一定质量铜铁合金样品中铁的质量分数,应根据Fe与稀硫酸反应生成氢气的量来计算铁的质量分数,则分液漏斗中加入的试剂是稀硫酸。