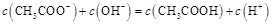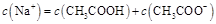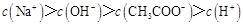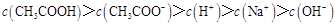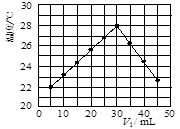题目内容
从手册上查得:H-H、Cl-Cl和 H-Cl的键能分别为436 kJ·mol-1、 243 kJ·mol-1和431 kJ·mol-1,请用此数据估计,下列热化学方程式正确的是
| A.H2(g)+Cl2(g)=2HCl(g); △H="-183" kJ·mol-1 |
| B.H2(g)+Cl2(g)=2HCl(g); △H=+183kJ·mol-1 |
| C.H2(g)+Cl2(g)=2HCl(g);△H=-91.5kJ·mol-1 |
| D.H2(g)+Cl2(g)=2HCl(g);△H=+91.5kJ·mol-1 |
A
反应热等于断键吸收的能量和形成化学键所放出的能量的差值,所以该反应的反应热为436kJ/mol+243 kJ/mol-2×431 kJ/mol=-183 kJ/mol,所以答案选A。

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
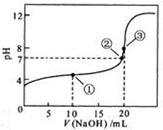
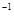 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L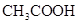 溶液所得滴定曲线如下图。下列说法正确的是
溶液所得滴定曲线如下图。下列说法正确的是